8月21日,海正药业发布公告称,重组抗PD-L1全人源单克隆抗体注射液获得药物临床试验批件。目前,具有相同靶点的上市单抗产品包括罗氏的Tecentriq(Atezolizumab)、默克/辉瑞的Bavencio(Avelumab)和阿斯利康的Imfinzi(Durvalumab)。
表1:临床试验批件主要内容
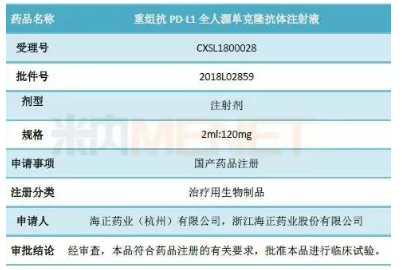
(来源:上市公司公告)
重组抗PD-L1全人源单克隆抗体注射液为PD-L1靶向的创新单抗药物,可结合PD-L1并阻断PD-L1与PD-1和CD80(B7.1)的相互作用,作用机制和已上市PD-L1靶点相同。具有相同靶点的上市单抗产品包括罗氏的Tecentriq(Atezolizumab)、默克/辉瑞的Bavencio(Avelumab)和阿斯利康的Imfinzi(Durvalumab)。
图1:2016-2017年罗氏的Tecentriq全球销售额(单位:亿瑞士法朗)
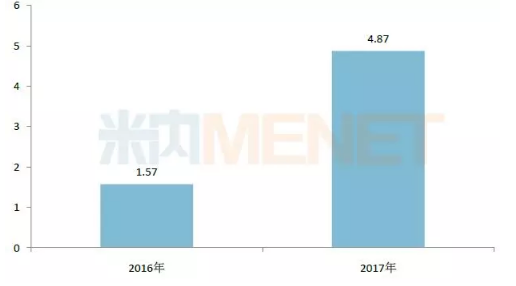
(来源:米内网跨国公司业绩数据库)
Tecentriq于2016年5月18日获得美国FDA批准上市,适应症为局部晚期或转移性尿路上皮癌和转移性非小细胞肺癌,2017年的全球市场销售额为4.87亿瑞士法郎。
Bavencio于2017年3月23日获得美国FDA批准上市,适应症为用于治疗12周岁以上患有转移性Merkel细胞癌(MCC)的儿童和成年患者,及局部晚期或转移性尿路上皮癌患者。
Imfinzi于2017年5月1日获得美国FDA批准上市,适应症为局部晚期或转移性尿路上皮癌和不可切除的III期非小细胞肺癌患者。目前相同靶点的单抗产品尚未在国内上市。
据悉,海正药业于2018年2月向CDE提交临床注册申请,后续公司将按照上述药物临床试验批件要求进行临床试验研究。截至目前,公司在该药品研发项目已投入1,810万元。



合作咨询
![]() 肖女士
肖女士
![]() 021-33392297
021-33392297
![]() Kelly.Xiao@imsinoexpo.com
Kelly.Xiao@imsinoexpo.com
 2006-2025 上海博华国际展览有限公司版权所有(保留一切权利)
沪ICP备05034851号-57
2006-2025 上海博华国际展览有限公司版权所有(保留一切权利)
沪ICP备05034851号-57