目前FDA新药申请主要分为3种形式:505(b)(1)、505(b)(2)和505(j),其区别可参见下表1.
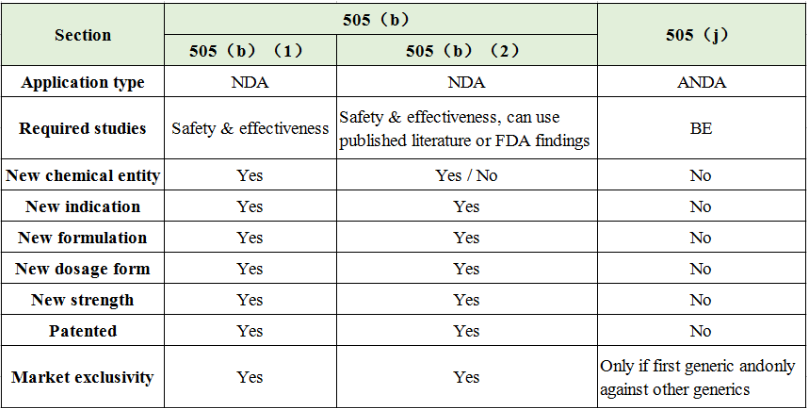
505(b)(1)和505(b)(2)被称为新药申请(NDA, new drug application),而505(j)则被称为简略新药申请(ANDA, abbreviated new drug application),即仿制药。
NDAs和ANDAs分类
505(b)(1):即独立NDA(stand-alone NDA),申请者提交的新药是基于FD&C505(b)(1)途径进行申报的,并经过505(C)获得批准。它的特点是其申请资料中需包括完整的安全性和有效性研究报告,且这些报告均来自于申请者或者申请者有使用它的权利。
505(b)(2):从表1 中可看出,基于505(b)(2)申请的也为新药申请NDA,它的申请资料中也需包括完整的安全性和有效性研究报告,但这些报告中部分信息并非申请者进行研究而获得的(即这些信息不是全部来自于申请者),申请者也没有引用它的权利。这些资料可来源于权威的文献或FDA发布的资料
ANDA:ANDA的申请即为“复制”一个已被批准上市的产品。其中,这里的“复制”是指其与该上市药品具有相同的活性成分、剂型、规格、服用方式及适应症等。这类申请可不用提交完整的安全性和有效性研究报告,取而代之的为生物等效性试验BE。
请愿性ANDA:请愿性ANDA是一种特殊的ANDA申报形式,是在RLD某些方面(如剂型、服用方式、规格或活性成分)进行改变的ANDA申请,这类申请也可不用提交完整的安全性和有效性研究报告。需注意的是,请愿性ANDA申请者需向FDA递交“公民请愿书(citizenpetition)”进行适用性请愿,FDA则会在90天的时间回应这类请愿;获得FDA批准性回复信后才可提交请愿性ANDA申请。
ANDAs与505(b)(2)
ANDAs申请
根据上文描述,ANDA是通过505(j)途径进行申请的,至少需符合以下三个条件:
·与RLD具有相同的活性成分、剂型、服用方式、规格、适用症和说明书;
·有足够证明其与RLD具有生物等效性;
·产品的成分、规格、质量和纯度均合格。
若满足上述三点要求,FDA一般是必须批准该ANDA的申请的,除非RLD仍处于市场独占期或专利期。
ANDA的申请是基于FDA对RLD的安全性、有效性的发现为基础的,因此,ANDA的申请无需再提交安全性和有效性研究报告。部分与RLD不一致的ANDA申请也可不用提交安全性、有效性研究报告,如前文提到的请愿性ANDA、非活性成分改变、包装容器改变等。
在美国,首仿ANDA拥有180天的市场独占销售权,这段时间只有原研或者授权ANDA同首仿ANDA同台竞争,面临的竞争环境较好,比普通ANDA的利润要丰厚得多。
505(b)(2)申请
505(b)(2)申请也是一种NDA申请形式之一,申请时需提交完整的安全性和有效性研究报告,但是,如果这些研究报告有部分内容不是申请者研究而来的,申请者没有权限使用这些数据,则这个时候需通过505(b)(2)途径获得NDA的申请。
505(b)(2)途径用得最多的是对已批准药物的改变,主要在以下几个方面:
·改变剂型,如JanssenPharms对利培酮的升级:利培酮片、利培酮口蹦片、利培酮口服液、利培酮注射液;
·改变规格,如10mg该为50 mg;
·改变给药途径,如由静脉注射变为腹腔注射;
·改变复方的成分组成,如复方中的一个活性成分被另一个未经批准的成分替代;
·改变药物组分,如辅料的质量和含量不同参比制剂,且不符合505(j);
·改变给药方案,如1天3片改为1天1片;
·改变活性成分,如活性成分成盐、成酯、成复合物等;
·改变适应症,如Glycopyrrolate最早被用于术前、**或插管过程中减少胃部和静脉分必物,后发现还能用于治疗罕见病脑性瘫痪;
·Rx变为OTC;
·选用天然或基因重组活性产物,即活性成分和RLD一样,但来源是天然或基因重组产物。
从全球新药研发成功率的角度来看,改良型的新药研发成功率:从I期临床到获批上市的整个过程来看,改良型新药的成功率是505(b)(1)的3.6倍。
505(b)(2)申请获批后也可获得一定时间的市场独占期:新产品通常是3年,如果是NCE市场独占期还可以延长到5年,如果是罕见病或儿童用药还可以分别延长至7年和6年,除此之外,还有定价和营销的优势,商业回报会明显提高。
因505(b)(2)申请时部分数据是来自于他人的,但回报率又比较高,因此,它也常被比喻为“站在巨人肩膀上的攀登之旅”。
后记
505(b)(2)、ANDA各有优势和短板:505(b)(2)除了有上述优势外,它没有505(b)(1)的加速审批机会,而ANDA则通常会面临着较严重的价格和市场竞争。



合作咨询
![]() 肖女士
肖女士
![]() 021-33392297
021-33392297
![]() Kelly.Xiao@imsinoexpo.com
Kelly.Xiao@imsinoexpo.com
 2006-2025 上海博华国际展览有限公司版权所有(保留一切权利)
沪ICP备05034851号-57
2006-2025 上海博华国际展览有限公司版权所有(保留一切权利)
沪ICP备05034851号-57