2018年9月28日,赛诺菲/再生元宣布FDA批准Libtayo® (cemiplimab-rwlc) 上市,成为目前唯一一个获批用于转移性/局部晚期皮肤鳞状细胞癌的药物,用药方案为350mg,静脉注射,Q3W,年花费15.4万美金。该药物成为全球第6款PD-(L)1抗体,这也是获批的全球第3款PD-1抗体,4月30日,FDA授予赛诺菲/再生元cemiplimab优先审批资格,仅用151天便获批上市。
笔者在这里简述了cemiplimab的EMPOWER-CSCC 1和临床I期扩展队列试验临床数据,并给出了赛诺菲/再生元关于cemiplimab的临床开发和商业化计划。
一.151天 cemiplimab加速上市:注册临床试验数据解析
cemiplimab是一款全人源PD-1抗体,上市申请的第一个适应症为转移性/局部晚期皮肤鳞状细胞癌(Cutaneous Squamous Cell Carcinoma,CSCC)。全球已有5款PD-(L)1抗体上市,cemiplimab以CSCC为切入点,临床2期试验后提交上市申请,监管机构显然有意加速PD-(L)1抗体审评,这也给CSCC带来全新疗法。

上文指出,cemiplimab此次上市申请中包含两项关键临床数据,即:1. 临床I期扩展队列试验数据,NCT02383212;2.临床II期试验数据EMPOWER-CSCC 1,NCT02760498。合并数据简述如下:
#临床I期扩展队列试验(该数据已在2017 ASCO年会上公布)
NCT02383212是一项开放标签、多中心临床I期试验,评估cemiplimab单药、cemiplimab联合放疗/化疗在晚期恶性肿瘤患者中的安全性、耐受性及有效性。其中,队列7,队列8分别招募转移性CSCC,局部晚期CSCC,分析结果与EMPOWER-CSCC 1合并。
#EMPOWER-CSCC 1
研究是一项开放标签、多中心临床II期试验,招募患者182人,评估Cemiplimab在转移性/局部晚期CSCC患者中的有效性和安全性,与上文中的扩展队列数据合并。
综合结果:
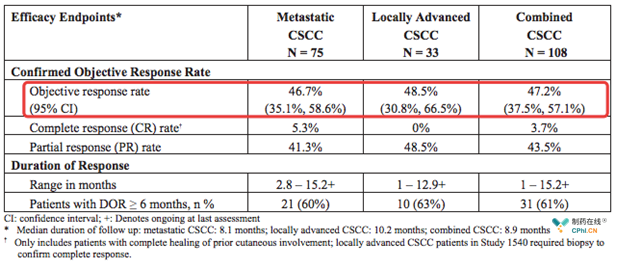
Cemiplimab在转移性、局部晚期患者中表现出良好安全性,更重要的是药物在PD-L1 < 1%患者中,同样有效。
二.Cemiplimab的产品开发规划
全球已有5款PD-(L)1抗体上市,cemiplimab定价在很长一段时间尚无法与opdivo,keytruda等相提并论,赛诺菲/再生元当然清楚这一点,赛诺菲/再生元同时公布定价为240mg:9100美金,年花费在15.4万美金,这与其他几款药物的定价是相当的,当然这里并未考虑保险或其他经济援助。
赛诺菲/再生元在年报中也对外批露了cemiplimab的开发计划,主要如下:
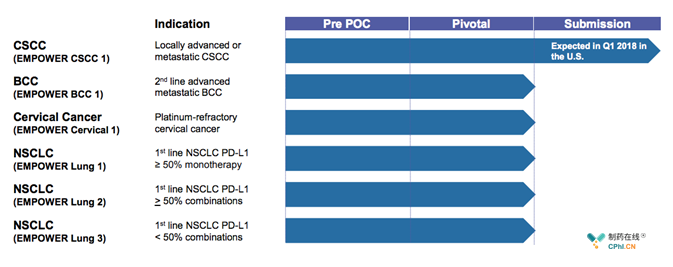
能够看出,cemiplimab目前开发适应症涉及到4个,赛诺菲/再生元将以CSCC为突破口,首先完成cemiplimab上市,其重要领域依旧关注NSCLC。下图为cemiplimab相关timeline,供读者参考。



合作咨询
![]() 肖女士
肖女士
![]() 021-33392297
021-33392297
![]() Kelly.Xiao@imsinoexpo.com
Kelly.Xiao@imsinoexpo.com
 2006-2025 上海博华国际展览有限公司版权所有(保留一切权利)
沪ICP备05034851号-57
2006-2025 上海博华国际展览有限公司版权所有(保留一切权利)
沪ICP备05034851号-57