随着越来越多的生物原研药获得批准上市,生物类似药由于在临床研究中的低投入及较低的售价也受到欢迎,据预测在今后的几年里Pfizer、Biogen、Novartis、Amgen和Mylan等将会引领生物类似药的市场。就地区而言,欧洲对生物类似药研发起步早、经验成熟且会一直处于领先位置,其目前已经批准37款生物类似药上市,而美国FDA仅批准11款生物类似药(实际上市为3款),发展缓慢。
生物类似药(Biosimilar)是原研生物药的仿制品,原研生物药的发展也将带动生物类似药的发展,生物类似药有望成为全球生物药市场增长的新引擎。
2017年全球药物销售榜Top30中有16款为生物制品,Top10中有8款为生物制品,AbbVie的Humira(Adilumumab,阿达木单抗)依然位居第一。在这8款生物制品中有5款为生物类似药临床研究及临床前研究的热门原研药,分别为:Humira、Remicade、Rituxan、Herceptin和Avastin,并且目前已经有相应的生物类似药上市。
表1 2017年全球药物销售额Top10
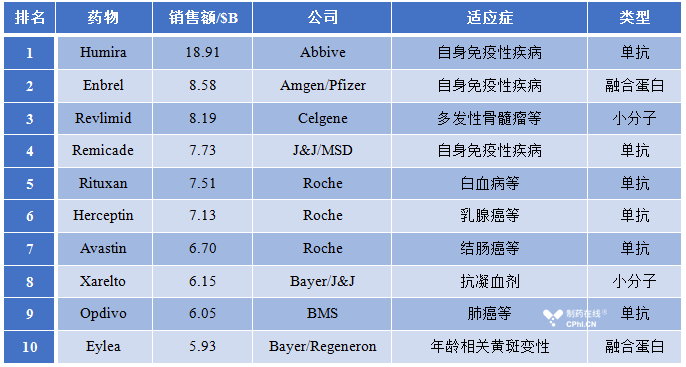
与原研药相比,生物类似药具有类似的药效且更加便宜,能够凭借其价格优势快速抢占市场份额,欧洲市场中生物类似药近年来一直以25-30%每年的比例侵占原研药的销售额。毫无疑问上面到的几款原研药的销售额都将受到影响,Roche的三款药物:Rituxan、Herceptin和Avastin,AbbVie的Humira,J&J的Remicade,以及Amgen的Neulasta和Epogen,来自Moody's的分析师预测这几家公司的收入将在未来的12-18个月内下降。
有输家也有赢家,由于目前已经有生物类似药获批上市或者正处于临床研究中,Pfizer、Biogen、Novartis、Amgen和Mylan被认为将会在销售额上引领生物类似药市场的发展。在Moody's的报告中估计到,2018年生物类似药将会为Pfizer带来8亿美元的收入,2020年为15亿美元;2018年Biogen(Bioepis)的生物类似药的收入为5.5亿美元,2020年为10亿美元;Novartis、Amgen和Mylan在2020年的生物类似药的收入分别为7.5、5和5亿美元。
从地域上讲,欧洲是生物类似药市场发展最为成熟的地区,也是最早出台生物类似药相关政策的区域。2005年欧盟颁布了第一版生物类似药指导原则《生物类似药指南(草案)》,并在2006年批准了第一个生物类似药Omnitrope,到目前为止已经有37种生物类似药(对应12种原研药)在欧洲获批上市,呈现快速增长的趋势。
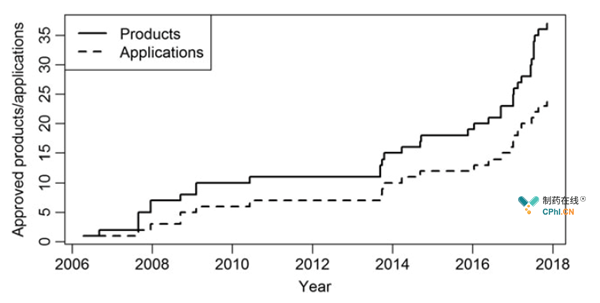
图1 到目前为止欧洲批准的生物类似药(来源于参考2)
相较而言美国生物类似药的发展较为缓慢、起步比较晚,直到2010年美国才制定了生物类似药进入市场的简化申请途径,并且在2015年正式批准第一个生物类似药Zarxio上市。目前为止FDA共批准了11款生物类似药,但仅有3款真正获得上市,分别为:Zarxio、Inflectra和Renflexis。
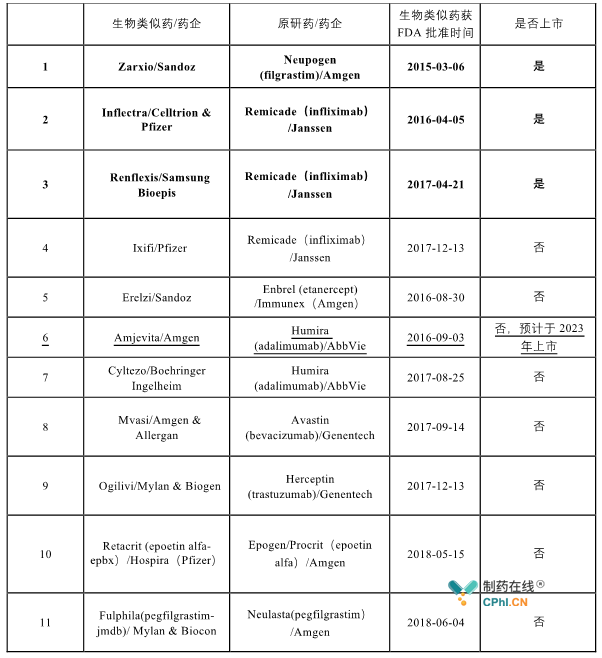
表2 FDA批准的11款生物类似药
比较EMA和FDA批准的生物类似药的数量,欧洲生物类似药的发展走在了美国前面。从欧洲的角度来看,一方面欧洲已经具有10年的生物类似药开发与批准的经验,相关法规与制度均比较完善;另一方面,欧洲各国对生物类似药的支持力度很大,体现在医保控费、鼓励医生使用生物类似药、通过学术会议推广生物类似药等,甚至有些国家会规定医生对生物类似药的用量要达到一定的配额。
与欧洲对生物类似药的推广不同,美国更加注重原研生物药的专利保护,FDA规定的生物创新药的市场独占期为12年,而EMA的规定中为10年;另外,FDA还颁布了一系列制度法案对原研生物药进行保护,用来解决原研药公司与类似药公司双方专利纠纷的制度,包括信息交换程序、专利范围谈判与诉讼、及上市前通知,被称为"专利舞蹈"。虽然FDA希望更加便宜的生物类似药进入市场以减轻医疗支出,但出于对原研药的保护减慢了其生物类似药的发展,获批的11款药物中仅有3款真正的上市销售,部分医药公司不得不缩小其生物类似药研发部门。
参考来源:
1. Moody's picks 5 early winners in biosimilar market;
2. An update on the clinical evidence that supports biosimilar approvals in Europe;
3. Biosimilars a growing challenge biotech drugs, with European market developing more quickly than the US。
作者简介:知行,生物化工硕士,从事细胞培养方面的研究。工作之余密切关注国内外医药行业动态以及研究进展,用简单的语言讲述不简单的未来,一个不断前行的医药人。



合作咨询
![]() 肖女士
肖女士
![]() 021-33392297
021-33392297
![]() Kelly.Xiao@imsinoexpo.com
Kelly.Xiao@imsinoexpo.com
 2006-2025 上海博华国际展览有限公司版权所有(保留一切权利)
沪ICP备05034851号-57
2006-2025 上海博华国际展览有限公司版权所有(保留一切权利)
沪ICP备05034851号-57