2018年11月01日,国家药品监督管理局审评中心发布公告--关于发布第一批临床急需境外新药名单的通知,公告更新了之前遴选出的48个临床急需境外新药,将其中未上市的40个品种名单按程序对外公布,名单中药物可通过专门通道加快审评,尚未申报的品种,可直接提出上市申请。
直接申请上市+上市后有效性和安全性评价,这是国家局目前对临床急需药物审评的重点,笔者借助此文汇总了这40款药物的中国注册进度,并列出了产品相关的影响企业。
一.40款临床急需药物:4款申请上市,5款处于3期临床
2018年11月01日,审评中心发布更新版的40个临床急需境外新药名单,主要包括多款罕见病药物、重磅抗肿瘤药物、基因疗法产品、反义疗法、丙肝DAA药物、银屑病药物等等。
笔者汇总了各个产品的中国开发进展,统计显示:
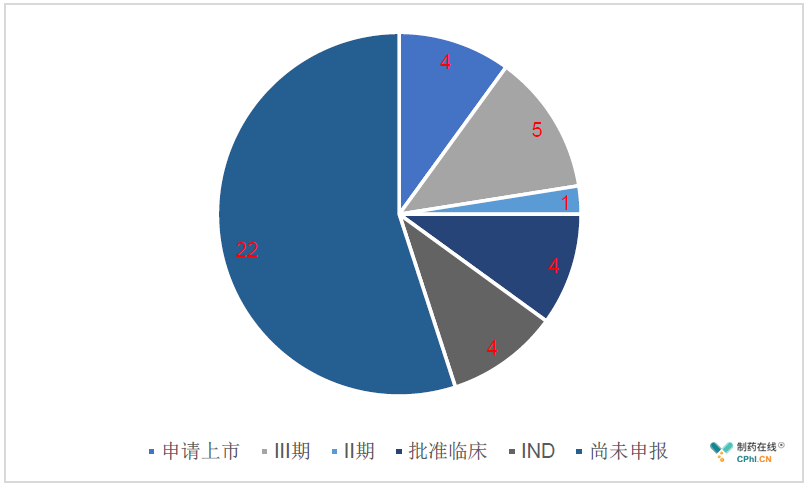
40款临床急需产品中:
1. 75%产品中国上市进程明显提速:
笔者统计显示,尚未在中国注册申报的占比55%,尚未开展临床试验(IND+批准临床)的占比25%,该政策的实施对于这类药物的加速上市具有明显的积极意义。
2. 6款产品已完成中国人群的临床试验
另外,统计显示,4款药物处于上市审评阶段,5款2-3期临床试验阶段的产品中2款已完成国际多中心临床试验。该政策的实施将会进一步加快药物的中国上市进程,同时药物上市后的有效性和安全性评价也将更为顺畅。
药物的中国开发进展详见下表:
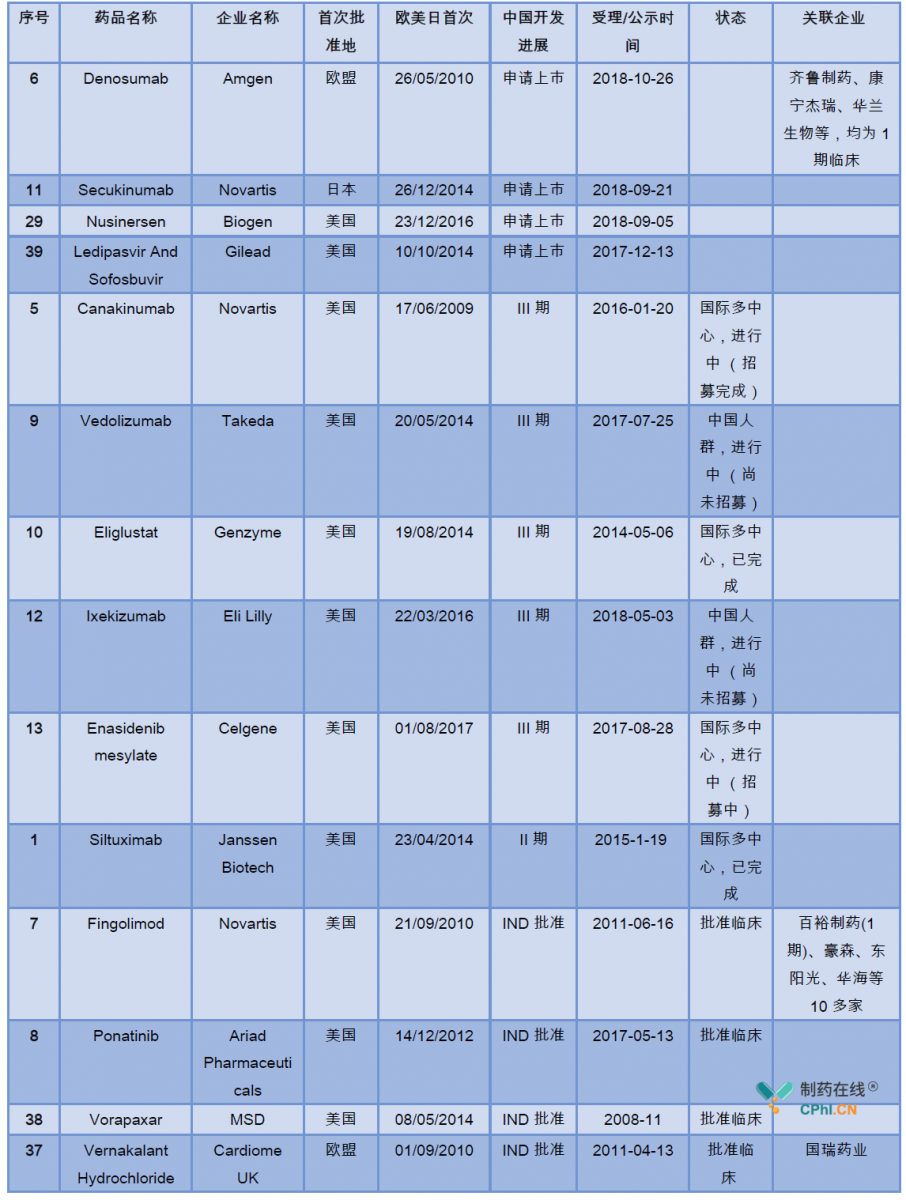
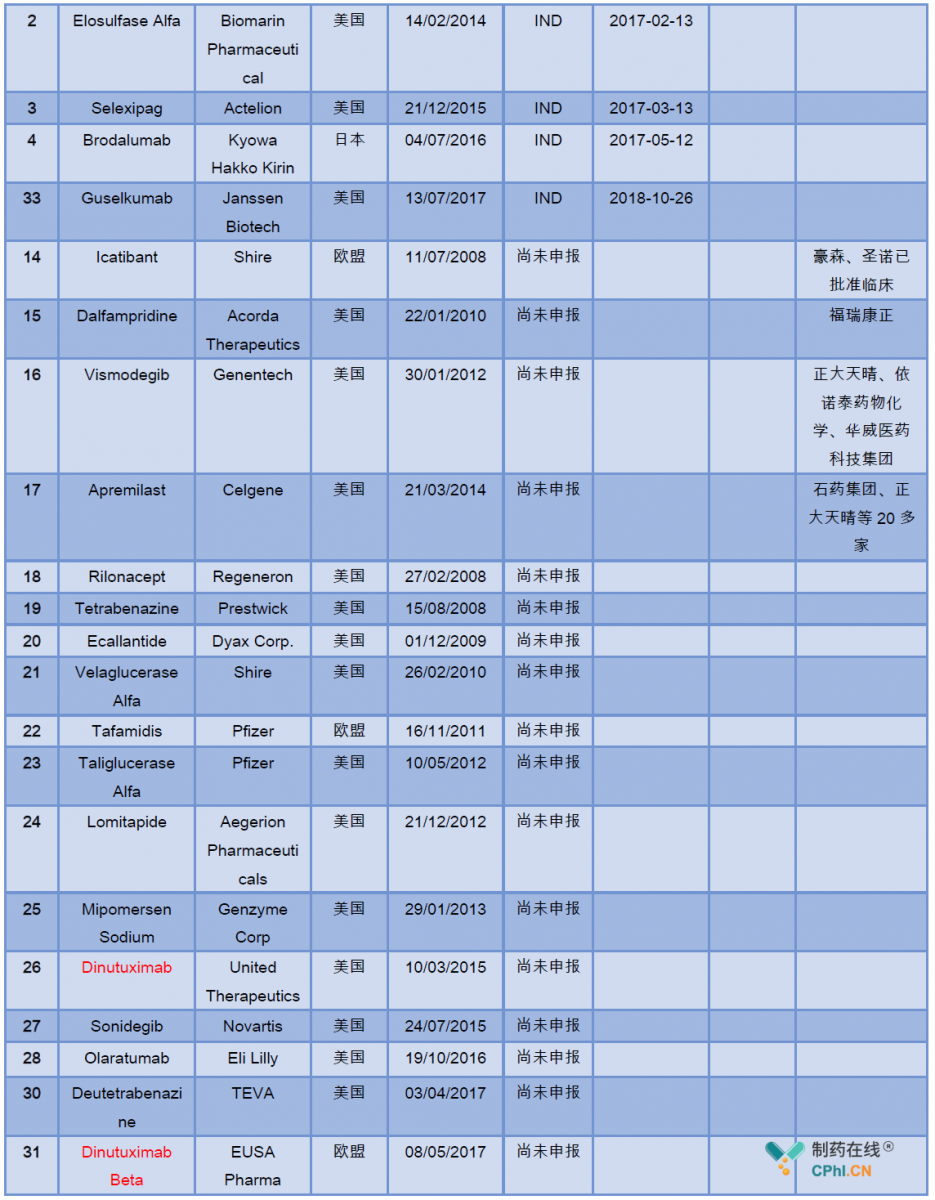
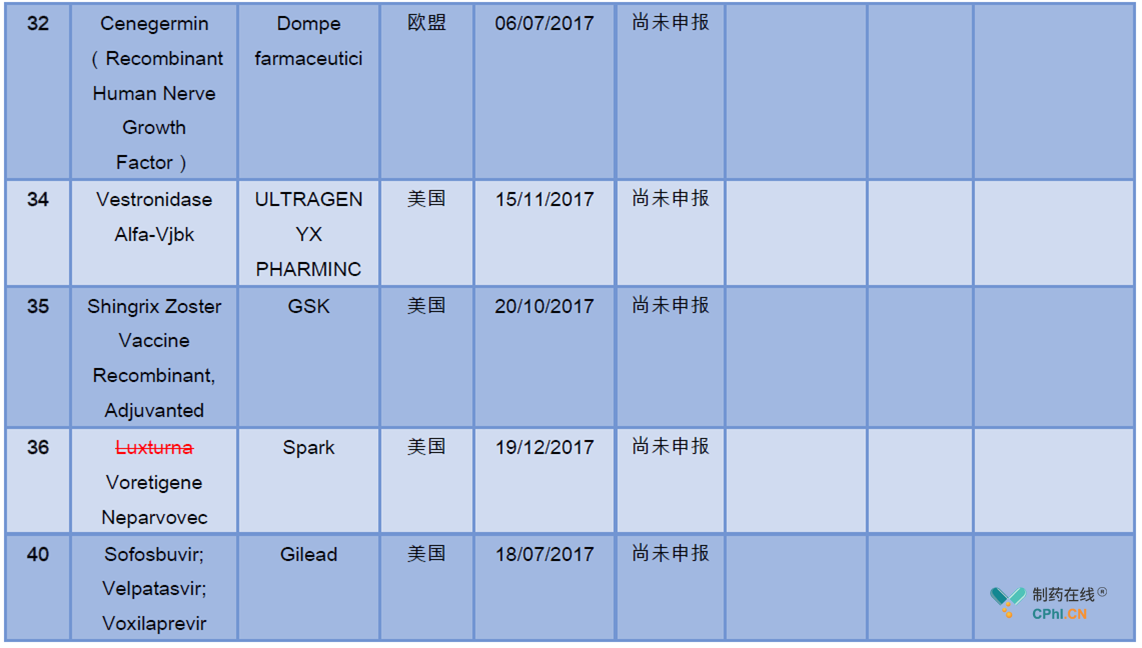
二.临床急需名单产品的关联影响企业分析
临床急需40款药物启动专门通道加快审评,原研产品的中国上市在明显提速,除了关注原研产品的中国开发进展外,笔者认为国内相关产品的仿制药/生物类似药的企业当然也应该对此重视,就目前的开发情况来看,原研产品的加速上市,将会对以下企业造成一定影响。
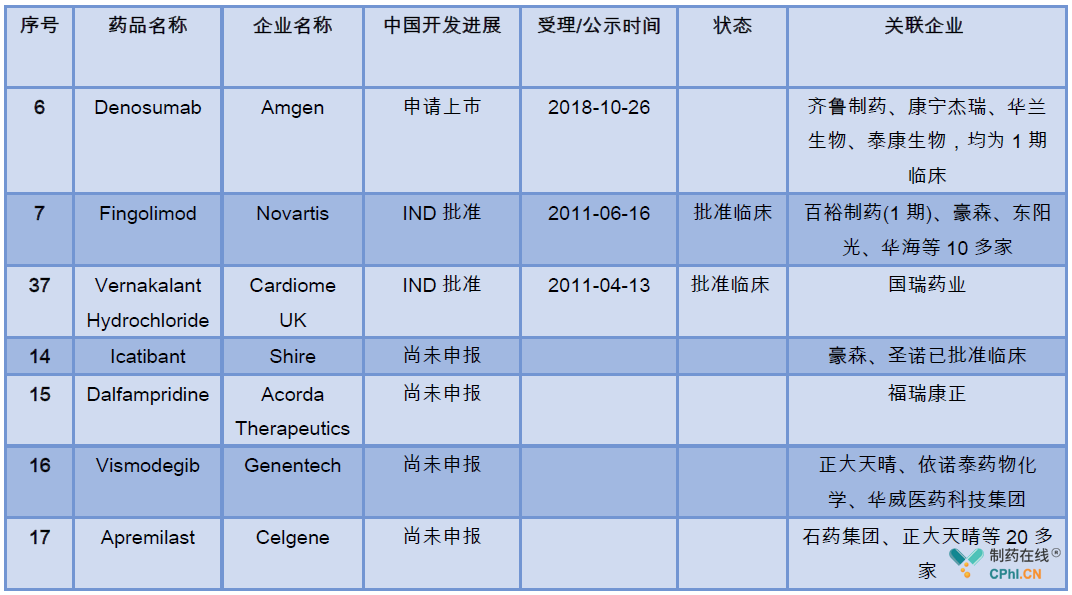
其中,Denosumab生物类似药,诺华多发性硬化症药物Fingolimod以及银屑病药物Apremilast均有多家企业在开发。
三.有条件批准再上市后评价是不是放松了监管?
这批名单中,多款临床急需药物纳入,笔者角度认为,重要的主要包含:1. 罕见病药物18款,如Siltuximab、Elosulfase Alfa、Selexipag、Eliglustat、Tetrabenazine、Ecallantide等,覆盖多中心卡斯特莱曼病、肺动脉高压、1型戈谢、亨廷顿舞蹈症、遗传性血管水肿等;2. 新型重磅抗肿瘤药物,如地诺单抗、Ponatinib、Enasidenib、Dinutuximab,覆盖骨巨细胞瘤、白血病、神经母细胞瘤等;3.银屑病药物,Brodalumab、苏金单抗等;4. 2款DAA丙肝治疗药物;5.基因疗法产品,Voretigene Neparvovec;6.反义疗法,Mipomersen。
40款药物中,尤其是那些中国尚未申报的产品,预计都会走这条专门审评通道,有条件批准再上市后评价是一个通用模式,但这是不是放松了监管?先看一个典型例子:
2018年09月04日,国家局批准依库珠单抗注射液(英文名:Eculizumab Injection)进口注册申请,用于治疗成人和儿童阵发性睡眠性血红蛋白尿症(PNH)和非典型溶血性尿毒症综合征(aHUS)。审评审批改革进程中,该药物的批准上市具有重要意义,是一个典型的按照临床急需药物、罕见病用药获批上市的产品。
该药物值得关注的点:
1. 豁免注册临床
2. 无中国人群临床数据
3. 成人和儿童适应症同时获批
4. 有条件批准
国家局指出:"专家评估认为该产品已在国外获批上市,临床疗效明确,风险可控,同意豁免本品注册临床试验;同时考虑到增加儿童适应症将给儿童人群带来的获益大于风险,建议一并批准。但同时要求申请人应补充本品上市后的有效性和安全性信息,按计划继续开展临床试验,并动态修订风险管理计划。国家药监局按照优先审评程序加快完成对本品的技术审评,于2018年9月4日有条件批准本品进口注册。"
这在2017年都是无法想象的一件事,罕见病药物一般成本巨大,中国患者支付能力是明显不足的,很多罕见病药物因此而刻意忽略了中国市场,近年来,国家局大力推进审评制度改革,有条件批注+上市后评价将成为临床急需药物的主流模式,国家局意在提高药物可及性,笔者看来,这里也有风险。个别产品无任何临床数据,早期临床用药具有风险;另外,上市后到底有多少企业能够推进上市后评价?很不确定,上市后审评很难开展,尤其是对于那些定价很高的产品。对于无任何中国人群临床数据,有条件批准+上市后评价药物,上市后评价需要新的模式,上市后监管应更为严格!
加快重磅创新药的中国上市意义深远、重大,国家局改革有目共睹,同时能够看出国家局发布的政策在刻意引导外企尽早将中国纳入早期临床试验体系中,加速中国医药国际化!



合作咨询
![]() 肖女士
肖女士
![]() 021-33392297
021-33392297
![]() Kelly.Xiao@imsinoexpo.com
Kelly.Xiao@imsinoexpo.com
 2006-2025 上海博华国际展览有限公司版权所有(保留一切权利)
沪ICP备05034851号-57
2006-2025 上海博华国际展览有限公司版权所有(保留一切权利)
沪ICP备05034851号-57