2018年11月05日,又是药物审评审批改革进程中具有重要意义的一天,第1批临床试验默示许可品种公示,又一重磅改革在高效推进。
国家药品监督管理局关于调整药物临床试验审评审批程序的公告(2018年第50号)值得仔细分析,笔者在这里分享几点思考,可供大家一起讨论。
一. 怎么查哪些品种已默示许可
CDE开设了专门的查询和公式页面:
进入CDE官方首页http://www.cde.org.cn/,点选临床试验默示许可公示,即可查询!
二. 60天 | 从费用收到日开始计算
60天是指从申请的费用收到日开始计算,且是60个工作日。
费用收到日,在这里可以看:
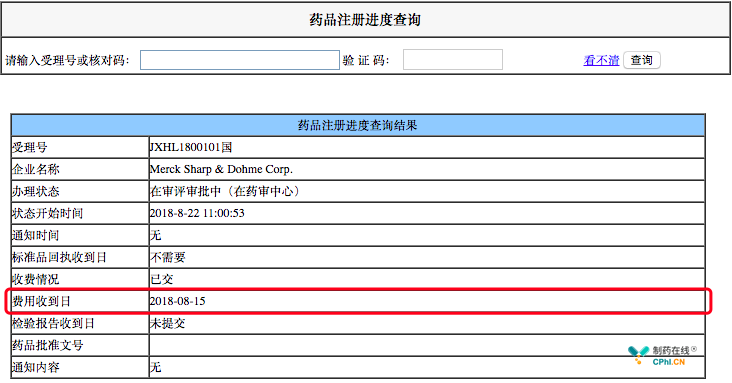
以受理号JXHL1800101为例
登陆NMPA官方首页http://www.nmpa.gov.cn/,右下点选"行政许可综合事项查询"
费用收到日:2018-08-15
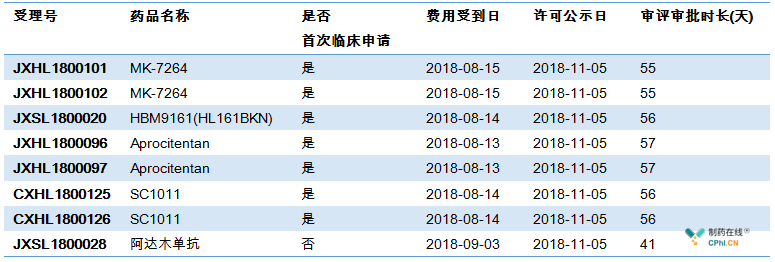
三. 第1批默示许可品种,审评时长平均为54.1个工作日
按照上文2种方法,我们可以查询到费用收到日,笔者特意标出了"是否为首次临床申请",8个品种审评审批时长41-57个工作日不等,均在60个工作日内,其中阿达木单抗最快,为41个工作日。
四. 打铁还需自身硬 | 临床经验越丰富 方案越完备 审评越快
50号文中,能够看出在整个临床试验申请中,有几个重要的影响整个临床试验申请时长的因素:
1. 是否首次临床试验申请
2. 申报资料是否符合审评技术要求
3. 是否被暂停临床试验,常见于申报资料无法按时补充,存在重大缺陷,或临床试验方案不完整的,或缺乏可靠的风险控制措施、存在潜在的临床风险而无法保障临床试验受试者安全的
4. 是否技术指南明确、药物临床试验有成熟研究经验
5. 申请人是否能够保障申报资料质量
6. 是否是国际同步研发的国际多中心临床试验申请
7. 是否在监管体系完善的国家和地区已经获准实施临床试验
所以,能够看出,随着受理号积压逐步彻底清理完成,审评审批流程效率提高,决定临床试验审评时长的越来越是申请方是否具有丰富临床试验经历,临床试验申请方案是否完备,打铁还需自身硬,盲目启动临床试验费时、费力、成本高。
参考资料:
1. http://www.nmpa.gov.cn/WS04/CL2111/329716.html



合作咨询
![]() 肖女士
肖女士
![]() 021-33392297
021-33392297
![]() Kelly.Xiao@imsinoexpo.com
Kelly.Xiao@imsinoexpo.com
 2006-2025 上海博华国际展览有限公司版权所有(保留一切权利)
沪ICP备05034851号-57
2006-2025 上海博华国际展览有限公司版权所有(保留一切权利)
沪ICP备05034851号-57