今日,以岭药业发布公告称,其全资子公司以岭万洲国际制药有限公司的全资子公司北京以岭生物工程技术有限公司向美国FDA申报的“阿那曲唑片”新药简略申请(ANDA,即美国仿制药申请,申请获得美国FDA审评批准意味着申请者可以生产并在美国市场销售该产品)已获得批准。
一、药品的基本情况
1、药品名称:阿那曲唑片
2、ANDA号:206037
3、剂型:口服固体片剂
4、规格:1mg
5、申请事项:ANDA(美国新药简略申请)
6、申请人:北京以岭生物工程技术有限公司
二、药品的其他相关情况
阿那曲唑片适用于绝经后妇女晚期乳腺癌的治疗以及绝经后妇女激素受体阳性的早期乳腺癌辅助治疗。阿那曲唑片由ANIPHARMACEUTICALSINC研发,于1995年在美国获批上市。当前,美国市场阿那曲唑片主要生产商为ACCORDHEALTHCARE和TEVAPHARMACEUTICA、BLUEPOINTLABS等。2017年6月-2018年6月阿那曲唑片1mg美国市场销售额约1577万美元(数据均来源于IMS数据库)。截至目前,公司在阿那曲唑片研发项目上已投入研发费用294万元人民币。
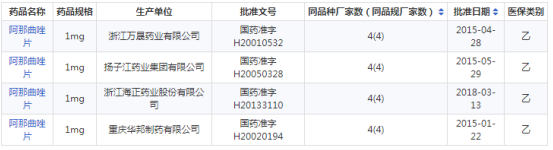
据药智数据,截止目前我国现有阿那曲唑片国产批文仅4条,生产企业仅4家,为浙江万晟药业、扬子江药业、浙江海正药业和重庆华邦制药,详情可见下图。



合作咨询
![]() 肖女士
肖女士
![]() 021-33392297
021-33392297
![]() Kelly.Xiao@imsinoexpo.com
Kelly.Xiao@imsinoexpo.com
 2006-2025 上海博华国际展览有限公司版权所有(保留一切权利)
沪ICP备05034851号-57
2006-2025 上海博华国际展览有限公司版权所有(保留一切权利)
沪ICP备05034851号-57