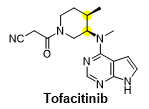
图一 托法替尼
托法替尼(Tofacitinib)是辉瑞公司开发的一种JAK抑制剂,于2012年12月获得FDA上市许可,用于风湿性关节炎的治疗,它可有效抑制JAK1和JAK3的活性,阻断多种炎性细胞因子的信号转导,既有研究表明托法替尼对除类风湿关节炎外,也对溃疡性结肠炎、银屑病等多种炎症相关疾病有良好的治疗效应。
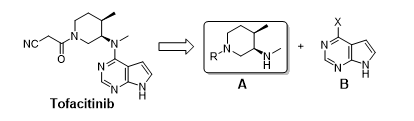
图二 托法替尼逆合成分析
作为首个上市的JAK选择性抑制剂,托法替尼的价格却也让人望而却步,60片/瓶的售价高达4284美元(5 mg/片,10 mg/片),平均每片托法替尼需要71美元,对于普通家庭来说,确实是一大负担,不过托法替尼在中国的化合物专利保护将在2020年过期,目前已有四川科伦、正大天晴、齐鲁药业三家公司展开仿制研发。托法替尼的结构可分解为两部分:手性哌 啶A和杂环B,两者可通过N-烷基化反应组装,其中手性中间体A是托法替尼生产的主要成本来源,同时也是工艺的瓶颈,由于其结构中含有两个手性中心,在制备中不仅需要解决对映选择性的问题,还要具备很好的非对映选择性,这无疑对高效的仿制带来困难,本文简要介绍Pfizer的专利路线,并以最近刊登在OPR&D上的一篇文章为参考,阐述AR-DKR反应在中间体A合成中应用。
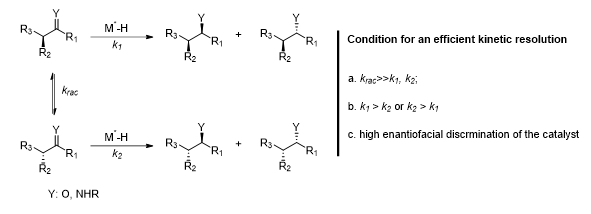
图三 AR-DKR反应
AR-DKR反应是指“不对称还原—动态动力学拆分反应”,早在1979年就有相关报道出现,反应底物通常为酮或者亚胺,在高手性区分的催化剂下,发生不对称还原反应,而此类反应成功的关键在于α位的消旋化速率krac要远大于两种异构体的氢化速率k1或者k2,选择不同的手性催化剂,k1、k2的差异不同,可以实现目标手性底物的制备,通过此方法可以高效的制备含有双手性中心的醇或者胺,而此两类结构在药物中也很常见,如加兰他敏、奥格列汀、甲砜霉素等,关于AR-DKR更为详细的介绍,可参考文末引用资料。
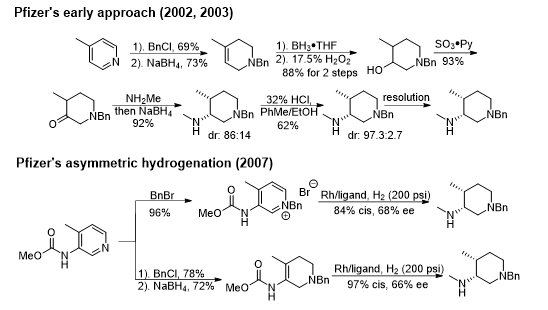
图四 Pfizer专利路线
Pfizer在其早期专利中公布的工艺路线还是采用经典的手性拆分法,但始终会造成至少50%的物料损失,在2007年公布的一篇专利中描述了不对称氢化去芳构化的路线,但是dr值或ee值均不理想(图三),因此世界各地的很多研究小组积极开展对中间体A的制备优化研究,包括手性拆分、采用手性原料(氨基酸、苹果酸等)、不对称氢化等,但是仍然未能有一个非常理想的解决方案!
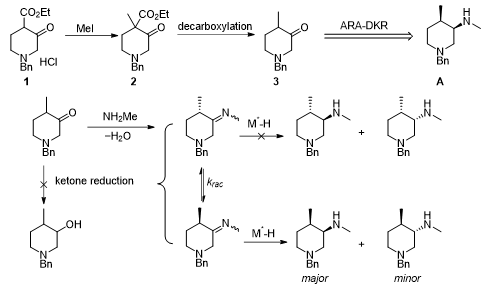
图五 托法替尼中间体A的ARA-DKR反应分析
在最新一期OPR&D杂志上,奥地利化学家Laurent Lefort报道了采用ARA-DKR反应制备中间体的A方法,以廉价易得的化合物1为起始原料,MeI甲基化后脱羧,两步反应得到不对称反应底物3。在进行不对称反应之前,要考虑到以下几点问题:1、亚胺的α位消旋化速率能否远远大于氢化反应速率;2、亚胺的E/Z构型是否会对催化剂的手性识别产生影响;3、以酮3作为底物,原位生成亚胺中间体,要保证酮不能够被还原,而仅有生成的中间体亚胺能被还原;4、最终产物A的非对映选择性(dr)以及对映选择性(ee)。
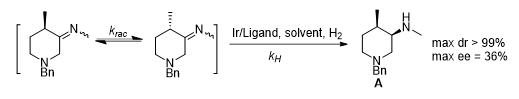
图六 初步的筛选结果
为了探索合适的催化剂和配体以及底物的反应性质,首先将3制备成亚胺,排除酮还原副反应的影响,根据经验选择Ir催化剂和12种手性配体,在不同的溶剂中,加碘或不加碘(碘是Ir催化氢化常见的活化剂)进行还原,结果显示,大多数反应都能够取得较好的非对映选择性(dr),但对映选择性(ee)仅有36%。以上数据表明,3a消旋化速率krac未能远远大于氢化速率kH,因此导致ee值较低,而理想的dr则表明Ir催化体系是合适的,因此问题的关键在于如何促进底物的消旋化和合适配体的选择。在上述反应条件中添加强碱tBuOK,结果发现仅有少数反应表现出优异的dr值,而ee值并未得到提高,可能是强碱破坏了手性配体,导致催化剂转变成非手性物质,因此强碱在该体系中并不合适。除了强碱外,酸也可以催化该消旋化反应,将3a和氘代醋酸混合后利用1H NMR分析,发现能够很顺利的发生消旋化。
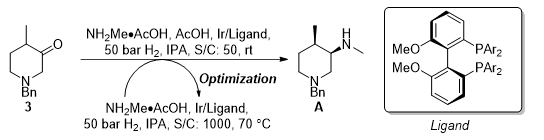
图七 反应的优化
经过上述的分析和探索后,直接采用化合物3作为反应底物,加入NH2Me•AcOH和醋酸,原位生成亚胺,发生不对称还原胺化,在该体系中,醋酸不仅能够催化亚胺的生成,同时也可以促进消旋化,另外有报道显示在Ir催化的不对称还原胺化中,加入醋酸能够提高催化剂的活性。在上述条件下反应,产物的dr选择性得到了保留,同时ee提高到了72%,说明发生了有效的消旋化,升高反应温度至70 oC发现即使不加醋酸,也能够发生消旋化过程,而提高S/C,且de和ee均有所提高。
上述反应策略,在条件下能够获得72% ee和95% dr,但这仍然还不够理想,手性药物的ee至少要达到99%以上,不过该路线简短可靠,仅需三步反应就能得到中间体A,通过与L-酒石酸重结晶的方法可以提高ee,此外,AR-DKR反应仅一步便可完成双手性中心的构建,显示出巨大潜力,也为国内药企仿制托法替尼提供一种思路。
引用资料:



合作咨询
![]() 肖女士
肖女士
![]() 021-33392297
021-33392297
![]() Kelly.Xiao@imsinoexpo.com
Kelly.Xiao@imsinoexpo.com
 2006-2025 上海博华国际展览有限公司版权所有(保留一切权利)
沪ICP备05034851号-57
2006-2025 上海博华国际展览有限公司版权所有(保留一切权利)
沪ICP备05034851号-57