致力为癌症和罕见遗传病开发新疗法的Agios Pharmaceuticals公司日前宣布,美国FDA接受了Tibsovo(ivosidenib)的补充新药申请(sNDA),治疗携带IDH1基因突变,且不适用化疗的急性骨髓性白血病(AML)初治患者。该申请获得优先审评资格,有望在2019年6月21日之前得到批复。
AML是成人中最常见的急性白血病,疾病进展快速,五年生存率约为27%。化疗是目前的标准治疗,但大部分患者对化疗没有反应,进展为复发/难治性AML。在大约6%~10%的AML病例中,存在异柠檬酸脱氢酶-1(IDH1)基因突变,造成正常的血液干细胞分化受阻,引起发病。
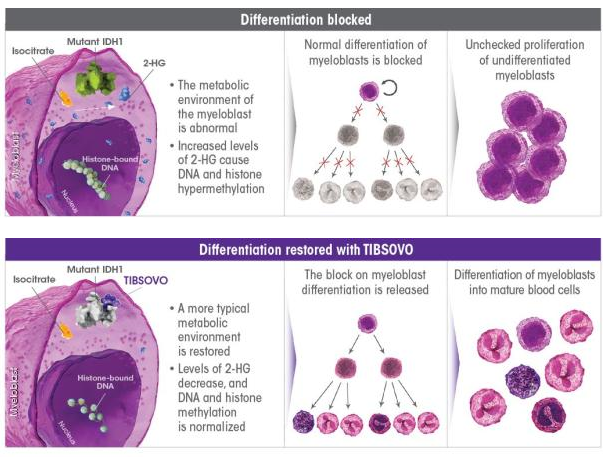
▲Tibsovo的作用机理(图片来源:Agios官网)
作为“first-in-class”口服IDH1抑制剂,Tibsovo已于2018年获得FDA批准,治疗经检测携带易感IDH1突变的复发/难治性AML成人患者。
此次sNDA申请将Tibsovo上升为AML一线治疗。FDA对申请的批准基于ivosidenib剂量递增和扩展的1期临床试验。这项研究中不适用标准治疗的初治AML患者组数据已在2018年美国血液学学会(ASH)年会上发布。
值得一提的是,这一申请被FDA纳入实时肿瘤学审评(Real-Time Oncology Review)试点项目,允许FDA在申请正式提交之前获取临床试验数据,进而加快药物审评的速度。
“在Tibsovo被批准用于治疗复发/难治性AML后,短短不到7个月,我们正在与FDA的合作将它扩展为一线疗法。”Agios首席医学官Chris Bowden博士表示,“新确诊的AML患者如果不能接受标准治疗,目前只能采用姑息治疗。因此,他们急切需要新治疗方案。我们相信,携带IDH1突变的AML患者将会受益于这种靶向疗法。”
点击下图,预登记观展



合作咨询
![]() 肖女士
肖女士
![]() 021-33392297
021-33392297
![]() Kelly.Xiao@imsinoexpo.com
Kelly.Xiao@imsinoexpo.com
 2006-2025 上海博华国际展览有限公司版权所有(保留一切权利)
沪ICP备05034851号-57
2006-2025 上海博华国际展览有限公司版权所有(保留一切权利)
沪ICP备05034851号-57