2019年03月11日,Allergan plc向FDA递交Ubrogepant上市申请,适应症为偏头痛,Ubrogepant将成为全球首款CGRP小分子偏头痛药物,PDUFA日期2019年第4季度。此次上市申请是基于4项临床试验,包括注册临床试验ACHIEVE I 和 ACHIEVE II安全性和有效性数据,以及UBR-MD-04 和 3110-105-002的安全性数据。
本文关注注册临床试验ACHIEVE I 和 ACHIEVE II数据,并概述全球CGRP市场重要产品开发进展。
一. Ubrogepant重要临床试验数据概述
上文提到,Ubrogepant此次上市申请主要基于4项临床试验数据,分别为ACHIEVE I, ACHIEVE II, UBR-MD-04, 3110-105-002。下文将会重点关注ACHIEVE I, ACHIEVE II安全性、有效性数据。
ACHIEVE I(UBR-MD-01)
A Phase 3, Multicenter, Randomized, Double-Blind, Placebo-Controlled Single Attack Study to Evaluate the Efficacy, Safety, and Tolerability of Oral Ubrogepant in the Acute Treatment of Migraine

ACHIEVE II(UBR-MD-02)NCT02867709
A Phase 3, Multicenter, Randomized, Double-Blind, Placebo Controlled Single Attack Study to Evaluate the Efficacy, Safety, and Tolerability of Oral Ubrogepant in the Acute Treatment of Migraine

ACHIEVE I & ACHIEVE II 临床试验数据显示:
50 mg,100 mg Ubrogepant vs 安慰剂
1. 初始剂量2h后,无疼痛患者比例为19.2% ,21.2% vs 11.8%
2. 初始剂量2h后,患者复杂症状消失比例为38.6%,37.7% vs 27.8%
3. 50 mg,100 mg Ubrogepant能够给偏头痛患者带来明显的临床获益
二.全球anti-CGRP靶点偏头痛药物概述
目前,全球处于III期至已上市anti-CGRP靶点偏头痛药物中共计7款,4款单抗,3款小分子药物。如下表:
全球anti-CGRP靶点偏头痛药物
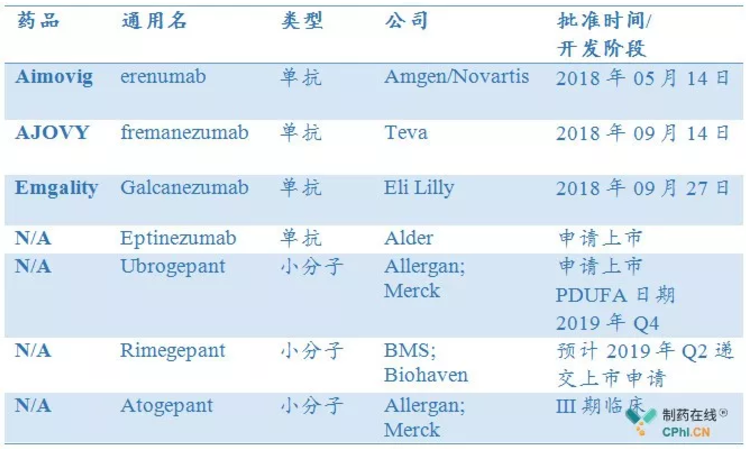
2018年,安进/诺华、Teva、Eli Lilly开发的CGRP单抗相继获批上市,定价$6900/年,其中,安进/诺华Aimovig (erenumab) 为同类首款CGRP单克隆抗体药物,此类药物的获批上市具里程碑意义,药物开启偏头痛新一代治疗方案。
相关公司财报数据显示,Aimovig (erenumab),AJOVY(Fremanezumab) ,Emgality (Galcanezumab) 2018年销售额分别为1.19亿美元,490万美元,300万美元。2019年销售额继续积极、快速增长,预计分别为5亿美元,2亿美元,1亿美元。
2019年,单抗药物Eptinezumab也将批准上市。Allergan plc开发的 Ubrogepant将成为全球首款口服CGRP小分子偏头痛药物,相关临床试验数据显示,Ubrogepant能够给偏头痛药物带来显著的临床收益,并具有良好的安全性和耐受性。
2019年03月13日,Biohaven宣布与FDA完成关于Rimegepant的pre-NDA会议,Biohaven开发的口服CGRP小分子拮抗剂Rimegepant将在2019年Q2向FDA递交上市申请,Rimegepant预计成为将成为全球第2款口服CGRP小分子偏头痛药物。
Evaluate Pharma预测CGRP市场2018年-2024年,市场份额将会稳步递增,同时抗体药物的市场份额将占据绝大多数。
附图:
CGRP市场2018年-2024年市场销售数据预测:

参考资料:
1. Allergan Announces FDA Acceptance of New Drug Application for Ubrogepant for the Acute Treatment of Migraine
2. UBROGEPANT ACHIEVE II RESULTS(Allergan 官网)
点击下图,预登记观展



合作咨询
![]() 肖女士
肖女士
![]() 021-33392297
021-33392297
![]() Kelly.Xiao@imsinoexpo.com
Kelly.Xiao@imsinoexpo.com
 2006-2025 上海博华国际展览有限公司版权所有(保留一切权利)
沪ICP备05034851号-57
2006-2025 上海博华国际展览有限公司版权所有(保留一切权利)
沪ICP备05034851号-57