2019年3月27日,诺华宣布FDA批准Mayzent上市,用于治疗复发型多发性硬化症(RMS)成年患者,同时也是FDA批准的首款治疗继发性进展型MS的药物,此次批准是基于III期临床试验EXPAND的优异数据。
多发性硬化症(MS)是一种慢性炎症性自身免疫疾病,患者的免疫系统攻击保护神经的髓鞘,导致大脑与身体其它部位的信息交流受阻,主要有三种类型:复发缓解型(RRMS)、继发性进展型(SPMS)和原发性进展型(PPMS),超过80%的RRMS患者会发展成SPMS患者。
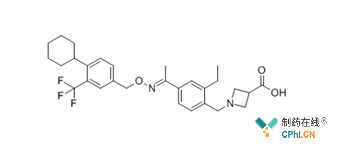
Mayzent(来源于MCE)
Mayzent(siponimod)是由诺华(Novartis)研发的,一种对鞘氨醇-1-磷酸(S1P)受体亚型S1P1和S1P5具有高度选择性的受体调节剂,其通过与淋巴细胞的S1P1受体亚型结合,防止淋巴细胞进入MS患者的中枢神经系统,从而降低炎症反应。2018年10月,诺华向FDA和EMA递交了Mayzent的上市申请。
2019年3月27日,诺华宣布FDA批准Mayzent上市,用于治疗复发型多发性硬化症(RMS)成年患者,包括RRMS和活跃的SPMS患者,一周内上市销售,据估计2024年Mayzent的销售额将达到13亿美元。
Mayzent的批准是基于III期临床试验EXPAND的成功,数据显示,与安慰剂相比,Mayzent显著降低了残疾进展风险(3个月确证残疾进展风险),达到了研究的主要终点。
表1 III期临床EXPAND试验设计与结果

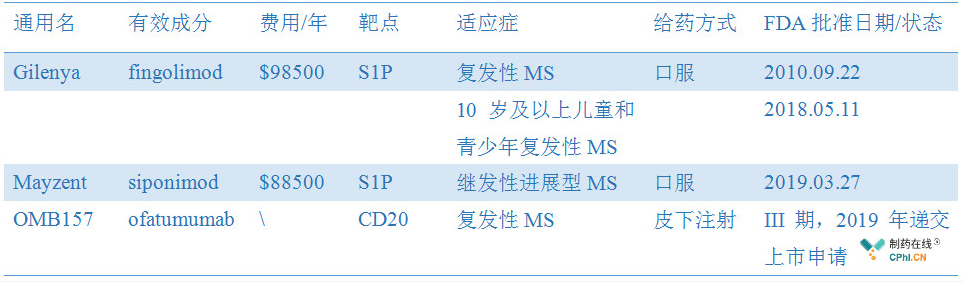
Mayzent是诺华第二款获得FDA批准的MS产品,2010年9月22日,FDA批准其Gilenya(fingolimod)上市,用于治疗复发性多发性硬化症;2018年5月11日,Gilenya获得治疗10岁及以上儿童和青少年复发性多发性硬化症的适应症拓展,成为首个FDA批准治疗儿童MS患者的药物。
OMB157(ofatumumab)是诺华的处于III期临床的在研MS药物,ofatumumab(Arzerra)已经获批治疗慢性淋巴细胞白血病。OMB157可以特性性靶向CD20阳性B细胞(髓鞘损伤的关键因素),具有快速的B细胞耗竭作用并保留免疫力的潜在有利安全特性,是罗氏Ocrevus强有力的潜在竞争对手。
表2 诺华的多发性硬化症资产
Mayzent的批准恰逢新基(Celgene)再次向FDA递交Ozanimod的上市申请,这或许会使新基和BMS感到担忧,一方面是MS市场竞争加剧,另一方面是诺华拥有涵盖Ozanimod剂量滴定的一项关键专利。
Ozanimod是新基认定的MS重磅炸 弹,也是BMS重金收购新基的关键之一。2018年2月,Ozanimod曾收到FDA的拒绝审评通知,补充非临床数据后,2019年3月25日新基再次向FDA递交Ozanimod上市申请,预计2020年获批上市,参与到MS市场竞争中。
参考来源:
1.Novartis snags blockbuster OK for secondary progressive multiple sclerosis drug Mayzent;
2.Novartis receives FDA approval for Mayzent? (siponimod), the first oral drug to treat secondary progressive MS with active disease;
3.Novartis wins key US approval for multiple sclerosis drug Mayzent。
作者简介:知行,用简单的语言讲述不简单的未来,一个不断前行的医药人。
点击下图,预登记观展



合作咨询
![]() 肖女士
肖女士
![]() 021-33392297
021-33392297
![]() Kelly.Xiao@imsinoexpo.com
Kelly.Xiao@imsinoexpo.com
 2006-2025 上海博华国际展览有限公司版权所有(保留一切权利)
沪ICP备05034851号-57
2006-2025 上海博华国际展览有限公司版权所有(保留一切权利)
沪ICP备05034851号-57