2019年03月28日,国家药品监督管理局、国家卫生与健康委员会组织有关专家研究论证,遴选出了第二批临床急需境外新药,为落实国务院常务会议有关会议**,加快临床急需的境外上市新药进入中国。
2018年以来,国家药品监督管理局深入优化临床急需境外新药审评审批,佳达修9,欧迪沃,可瑞达,Soliris (依库珠单抗)等一批创新药加速进入中国,本文重点分析国家局发布的第二批临床急需境外新药,并同时简单更新第一批名单中药物中国开发进展。
一.政策助力:全球创新药物加速进入中国
近年,国家局推出多项重要的审评审批政策,如优先审评、接受药品境外临床试验数据、优化进口创新药审评程序、临床默示许可等等,系列政策给全球创新药加速进入中国提供了前所未有的机遇,这其中,罕见病药物更是受益颇多,罕见病药物在中国上市的机会难得一遇。
此次,第二批临床急需境外新药名单有一个明显特点:罕见病药物比例占一半,第二批名单中15款药物为罕见病用药,如β-半乳糖苷酶A缺乏的治疗药物Fabrazyme(Agalsidase Beta);除此外,有多款药物以"较上市产品有治疗优势"纳入名单中,如丙肝药物Maviret,艾滋病药物Biktarvy。
第2批临床急需境外新药中,尚有多个值得关注的点,具体的:
1. 多个药物国内已上市 药物凭借单适应症进入名单
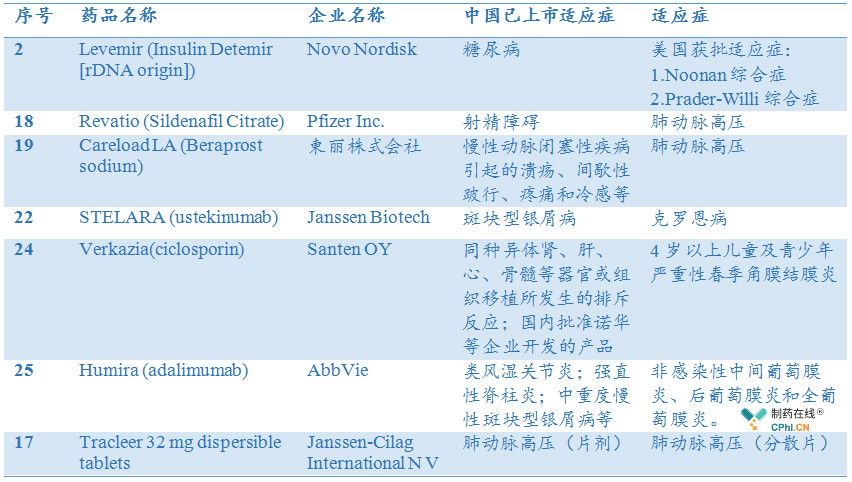
根据笔者所查询到的信息,第二批名单中药品已在国内上市,药物凭借某单适应症进入名单,例如地特胰岛素用于Noonan 综合症,乌司奴单抗用于克罗恩病,阿达木单抗用于葡萄膜炎,Santen开发的贝前列素新适应症角膜结膜炎。
另外,爱可泰隆波生坦分散片同样进入名单,根据笔者查询到的信息波生坦片已在国内上市,药物凭借新的剂型进入。
这些药物进入第2批临床急需名单后,其后续的特定的新适应症拓展或是新剂型获批将会进一步加速。
2. 名单中5款药物处于上市申请阶段
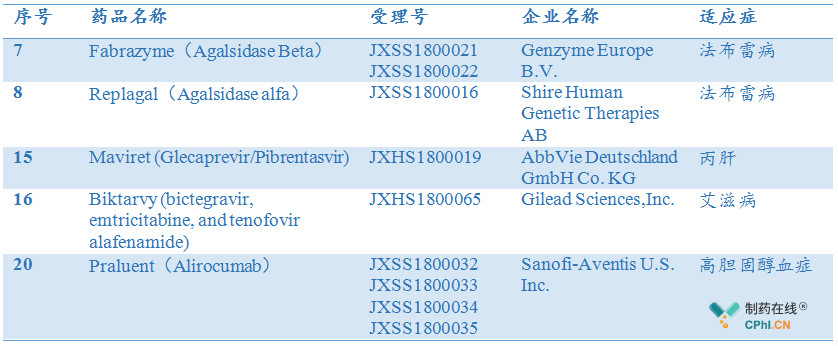
除上文提到的已上市药物外,有5款药物已向NMPA递交上市申请,这其中包括两款罕见病药物,即法布雷病治疗药物阿加糖酶α/β,以及3款具有明显治疗优势的药物如,丙肝直接抗病毒 药物Maviret,艾滋病药物Biktarvy,PCSK9单抗Praluent(Alirocumab)。
这其中,Mavyret 将会进一步增加丙肝患者治疗选择,其治疗周期减少(唯一一款疗程为8周的DAA药物)、治疗费用大幅降低,为同类产品。
艾滋病药物Biktarvy则是吉利德推出的一款整合酶抑制剂类完整方案单一片剂药物,是目前美国一线用药,而国内艾滋病用药依旧十分落后,固定剂量复方缺乏,疗效优异的整合酶抑制剂产品更是罕见,医保对固定剂量复方或完整方案单一片剂药物覆盖极差,该款药物上市将会大大提高国内艾滋病药物的可及性,改善患者用药。
3. 9款药物处于临床阶段
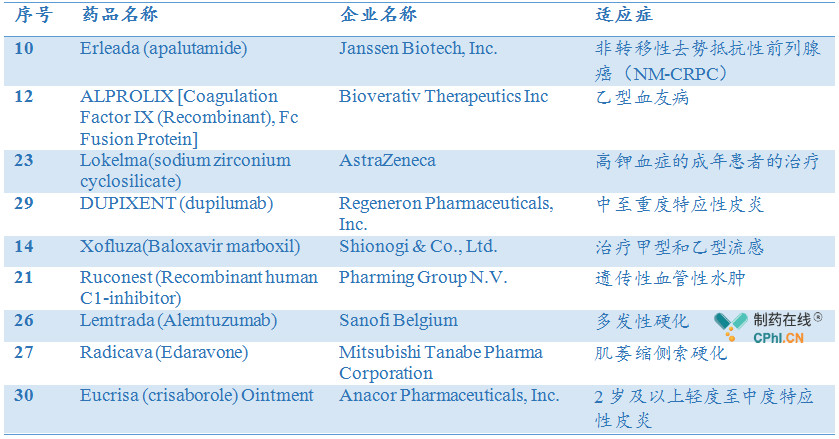
处于临床阶段的9款药物,多为近3年全球批准上市的创新药物,其中Erleada (apalutamide),Lokelma (sodium zirconium cyclosilicate),Xofluza (Baloxavir marboxil)更是2018年刚刚在欧盟或是美国获批,纳入名单后,药物中国上市进程将会进一步提速。
4. 尚未在中国国内申报的药物
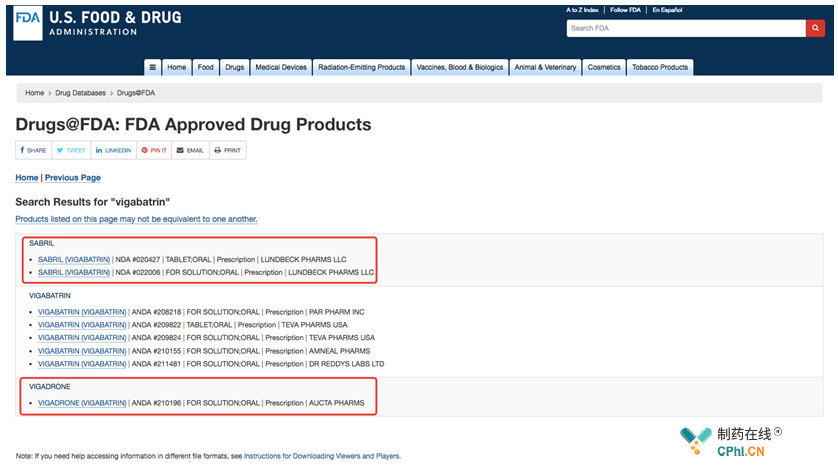
在9款仍未有任何申报的药物中,药物可直接国内递交上市申请。其中,有1款特别值得关注,即Vigadrone(vigabatrin)。
目前,国内远大医药按照3类仿制药在开发药物vigabatrin,受理号CYHS1800517,拟纳入优先审评,公示后未通过。
同时,国家局给出的美国首次批准时间是错误的,vigabatrin美国首次以商品名SABRIL获批上市, Ovation Pharmaceuticals(Lundbeck收购该公司)开发,该药物美国首次批准时间应该为2009年08月21日,该信息可在FDA官网核实。
二. 第一批临床急需境外新药审评进展
2018年12月10日,笔者前文中特地更新了第一批临床急需境外新药审评进展,详见(第一批临床急需新药审评进度更新:多款药物通过简化审评获批上市),下文将在前文的基础上,更新最近值得关注的几个进展。
第一批临床急需清单中,共计40款药物,其中4款药物已经先后获批上市,代表如罕见病药物Nusinersen。另外,该批清单中有一个值得关注的药物,即礼来开发软组织肉瘤药物Olaratumab,2018年12月10日,CDE承办上市申请,目前办理状态已处于"在审批"。
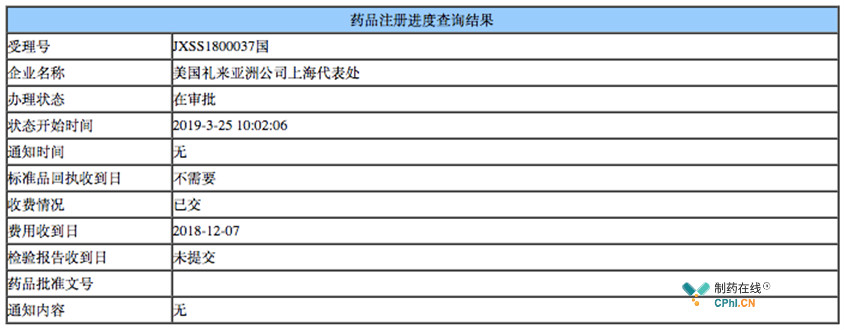
但是,2016年药物加速批准上市,后续验证性临床试验ANNOUNCE, NCT02451943未达到临床终点,礼来2018年财报中披露,Lartruvo 2018年销售额达到3.04亿美元,同时,礼来已经停止该药物的推广,FDA和EMA均发布公告,1.新发软组织肉瘤患者不推荐使用 Lartruvo (olaratumab);2. 正在药物治疗患者中,应咨询医生等专业人士,是否应该继续药物治疗。

Lartruvo (olaratumab)中国加速获批上市后,同样应该继续监测和评估药物的临床获益。
能够预测,未来将有更多药物通过此通道获批上市,纳入临床急需新药名单将大大加速其上市进程,具体的:
1. 已递交上市申请的,需要补充部分资料(如人种差异研究资料,上市后研究和上市后风险控制);
2. 已经递交IND的,可改为上市申请,并补充资料;
3. 未在国内申报的,直接上市申请。
上述针对名单药品所专设的药品审评审批通道无疑将会明显提高国内创新药物的可及性,中国敞开怀抱,热情拥抱全球创新药物。
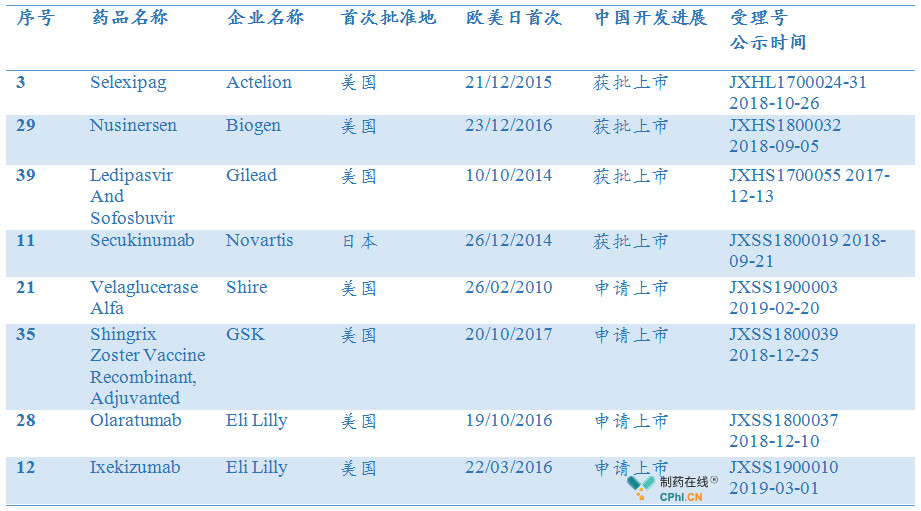
第一批临床急需用药中国开发进展更新
点击下图,预登记观展



合作咨询
![]() 肖女士
肖女士
![]() 021-33392297
021-33392297
![]() Kelly.Xiao@imsinoexpo.com
Kelly.Xiao@imsinoexpo.com
 2006-2025 上海博华国际展览有限公司版权所有(保留一切权利)
沪ICP备05034851号-57
2006-2025 上海博华国际展览有限公司版权所有(保留一切权利)
沪ICP备05034851号-57