2000年前后对中国生物医药行业来讲具有划时代意义,一大批科学家海外归来,开启了中国生物制药的新篇章,诞生了当下药明康德、凯美纳、康柏西普、西达本胺等众多响当当的名字,大家在不同的模式下,取得了各自的成就。
西达本胺,诞生于此,贯穿了整个微芯生物的发展,沪亚生物也因与其合作收益颇丰。微芯生物的发展史就是这个时代医药人奋斗史。
西达本胺片及其专利授权许可收入的合计在2016年、2017年和2018年分别达8,529.96万元、11,028.87万元和14,651.14万元,占公司同期营业收入的比例分别为99.92%、99.81%和99.20%。西达本胺片及其专利授权许可收入合计占公司同期营业收入的比重超过99%,绝 对的收入主力军。
西达本胺(商品名为"爱谱沙®/Epidaza®")属于表观遗传调控剂药物,2015年首 次获批用于既往至少接受过一次全身化疗的复发或难治的外周T细胞淋巴瘤患者,是国际上首 个亚型选择性组蛋白去乙酰化酶(HDAC)抑制剂,也是中国首 个以II期临床试验结果获批上市的药物,亦是目前中国唯一治疗外周T细胞淋巴瘤的药物。2017年纳入国家医保目录。
西达本胺属苯酰胺类化合物,为一种组蛋白去乙酰化酶(HDAC)抑制剂。HDAC包括18种亚型,西达本胺可选择性抑制第I类的1、2、3亚型和第IIb类的10亚型。研究表明HDAC具有对肿瘤发生发展相关的表观遗传异常的重新调控作用,其数量过多和/或活性异常与肿瘤细胞的异常基因表达有关。西达本胺能通过抑制HDAC的生物学活性产生作用,并由此产生针对肿瘤发生的多条信号传递通路基因表达的改变(即表观遗传改变)。
图:西达本胺的一般性作用机理
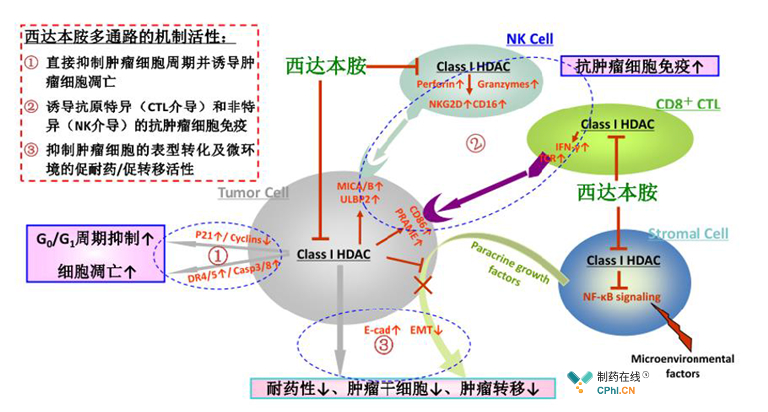
公司及公司研究人员已发表和申请与西达本胺相关文章19篇,专利20项。
西达本胺的境内化合物专利(专利号:ZL03139760.3、ZL03146841.1)将于2023年到期,西达本胺的晶型及其制备专利(专利号:ZL201210489178.8)、西达本胺用于癌症治疗的用途专利(专利号:ZL201410136761.X)分别将于2032年和2034年到期。
图:西达本胺海外授权及进展
外周T细胞淋巴瘤
2015年首 次获批用于既往至少接受过一次全身化疗的复发或难治的外周T细胞淋巴瘤患者。支持本次获批的主要依据是在PTCL进行的一项单臂、开放、多中心、Ⅱ期试验(TG0902CDM)。共入组了102例既往至少经过一次全身治疗后的复发或难治性PTCL患者。研究分为两个阶段,在探索性阶段共纳入19例患者,考察了两个剂量组(30mg/次或50mg/次)按相同间歇给药方式(每周两次,连续给药2 周后停药休息1 周)的疗效和安全性。
在关键性阶段,入组受试者83例,主要终点ORR,评价方法:采用NCCN指南2008版的淋巴瘤疗效评价国际工作标准IWC(Cheson)。
最终确认缓解的有23 例,客观缓解率为:29.1%(23/79),95%CI:19.4%~40.4%;其中CR 8 例(10.1%),CRu 3 例(3.8%),PR 12 例(15.2%);经独立疗效评估确定有22例缓解,客观缓解率为27.8%。
≥3 个月持续缓解率为24.1%(19/79),95% CI 为15.1%-35.0%。达到最初设定目标。
恶性淋巴瘤是源自淋巴造血系统的恶性肿瘤总称,分为霍奇金淋巴瘤(HL)和非霍奇金淋巴瘤(NHL)两大类,以NHL更为常见。NHL再分为T细胞源性和B细胞源性。外周T细胞淋巴瘤(PTCL)是一组异质性的淋巴细胞异常增殖性疾病,发生率具有明显的地域和种族特征,东方人更为常见;在欧美占NHL的10-15%。美国每年新发病例约9500例。在中国,占所有NHL的29.6-39.1%(淋巴瘤.石远凯主编北京大学医学出版社)。据估算,中国年发病人数约在5万人左右(就诊新发病例约在1.5万~至2.5万),外周T细胞淋巴瘤绝大部分亚型属于侵袭性淋巴瘤,中位生存期约2年,3年总生存率(OS率)为43%,5年OS率在26%(欧洲、中国香港等)至37%(美国)。
目前尚无标准的推荐治疗方案。CHOP或CHOP类似的化疗方案是最常见的一线药物治疗,可获得70%左右的缓解率。公司正在开展上市后试验(CTR20160280),观察西达本胺片联合CHOP化疗(C-CHOP方案)治疗未经过系统药物治疗的PTCL患者的疗效和安全性。
国内竞品分析:
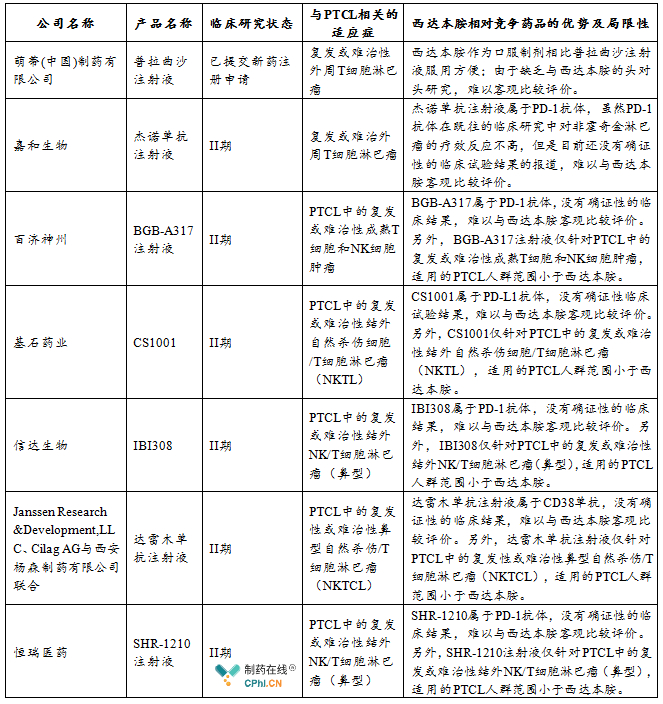
西达本胺是国内唯一的PTCL治疗药物,也是全球首 个PTCL口服药物。目前世界范围内用于PTCL的药物除了传统的CHOP或CHOP样方案,还包括普拉曲沙、罗米地辛(FDA批准的第二款HDAC抑制剂)和贝利司他(第三款上市HDAC抑制剂),但国内均未上市。其他正在开展临床试验的新技术或新药还包括针对CD30靶点的细胞治疗(CAR-T)、PD-1抗体类药物等,其临床疗效尚待进一步验证。格局良好。
目前国内已进入临床II期及已提交注册申请的针对外周T细胞淋巴瘤(PTCL)或其亚型的西达本胺竞争药物情况如下表所示:
乳腺癌
西达本胺用于激素受体阳性晚期乳腺癌适应症的新药申请已提交国家药监局,获优先审评,该申请基于关键临床CTR20150456,西达本胺联合依西美坦治疗激素受体阳性晚期乳腺癌,入组受试者365人,本试验分为两个部分,即开放期和双盲对照期。
开放期:(1)主要目的:观察和评价药代动力学(PK)特征、药效动力学(PD)特征;(2)次要目的:观察和评价初步疗效和安全性。
双盲对照期:评价西达本胺片联合依西美坦片治疗激素受体阳性晚期乳腺癌患者的疗效和安全性,为西达本胺增加新适应症上市审批提供支持依据。
试验结果:在已完成的入组人群为绝经后雌激素受体阳性、HER-2阴性、经既往内分泌治疗(辅助或解救)复发/转移的晚期乳腺癌患者的关键性III期临床试验中,西达本胺联合依西美坦与单用依西美坦相比,可显著延长患者的无进展生存期(PFS),其中在有内脏转移的患者中差异更明显。同时,西达本胺联合依西美坦在客观缓解率、临床获益率方面均优于安慰剂联合依西美坦。不良反应特点与既往使用西达本胺单药报道相似,大部分患者可以耐受。
乳腺癌是发生在乳腺腺上皮组织的恶性肿瘤。女性:男性比为99%:1%。据世界卫生组织国际癌症研究中心统计,2012年全球女性乳腺癌新发病例已达167.1万,占全部女性恶性肿瘤发病人数的25.1%,52.2万女性因乳腺癌死亡,占所有女性恶性肿瘤死亡的14.7%。根据国家癌症中心发布的全国癌症统计数据,乳腺癌属于我国女性发病率的癌症,2014年我国女性乳腺癌发病率41.82人/10万。乳腺癌的死亡率在所有癌症中处于中等水平,2014年我国女性乳腺癌的死亡率9.9/10万。统计当年(2014年)中国女性乳腺癌新发病例达27.9万,并且以每年2%的速度递增,死亡约7万例。在低于45岁女性中,乳腺癌位居癌症死因的首 位,并且呈现年轻化趋势。部分乳腺癌患者在发现时经常已经开始转移,耽误了治疗时机。在每年新发乳腺癌病例中3%~10%的妇女在确诊时即有远处转移,早期患者中30%~40%可发展为晚期乳腺癌。晚期乳腺癌患者的总体中位生存期为2~3年,不同分子亚型的情况不同。其中激素受体(ER)阳性乳腺癌约占全部乳腺癌的70%,属于乳腺癌中比例的类型。根据米内网数据,2016年我国乳腺癌用药总体规模已超过320亿元,同比增长11.67%。据此估算2016年我国激素受体阳性晚期乳腺癌用药总体规模约78.4亿元。
国内竞争分析
针对晚期激素受体阳性乳腺癌患者,国内已批准的或进入临床II、III期及已上市的针对同一适应症的主要竞争药物及发行人相对于竞争药品的优势及局限性情况如下(不包含仿制药):
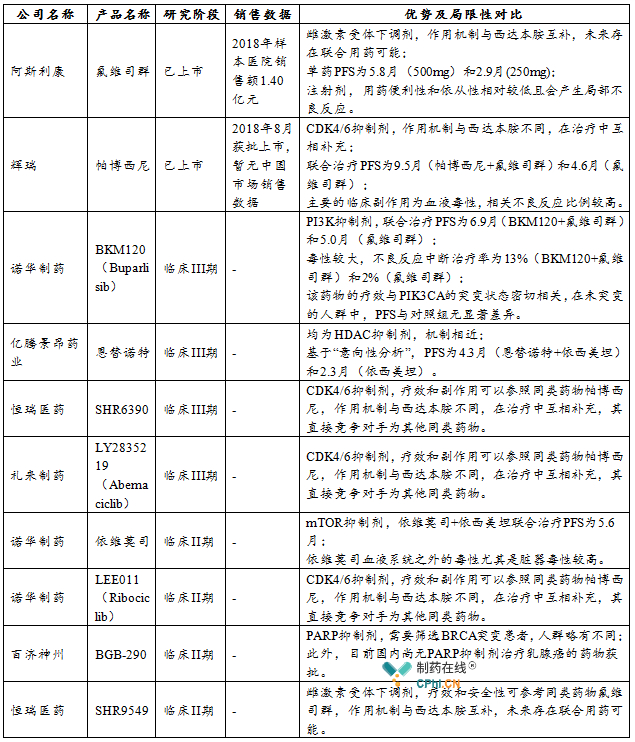
在研品种较多,不过临床针对晚期乳腺癌主要采用联合用药方式,在患者对某一类别药物产生耐药后会采用另一类别药物进行治疗。针对晚期激素受体(HR)阳性乳腺癌治疗,国际上有3个CDK4/6抑制剂类药物获批作为内分泌治疗方案的联合用药,其中帕博西尼于2018年在中国获批上市,还有一些国内企业的类似药物正在临床试验阶段。在研药物机理不同,仅有恩替诺特为HDAC抑制剂,正在开展III期临床试验,竞争格局良好。
非小细胞肺癌
针对晚期非小细胞肺癌适应症正在进行II/III期临床试验(CTR2032000,西达本胺联合紫杉醇和卡铂治晚期非小细胞肺癌),主要目的:评价西达本胺联合紫杉醇和卡铂治疗晚期非小细胞肺癌患者的疗效。次要目的:评价西达本胺联合紫杉醇和卡铂治疗晚期非小细胞肺癌患者的安全性。
非小细胞肺癌是除小细胞肺癌外所有肺癌组织分型的总称,包括鳞状细胞癌、腺癌和大细胞癌。根据国家癌症中心发布的统计数据,2015年我国新发肺癌病例78.7万人,经过年龄标准化的肺癌年发病率约为35.96/10万人。非小细胞肺癌约占总体肺癌患者的85%,据此推算2015年我国新发非小细胞肺癌病例66.90万人,经过年龄标准化的年发病率约30.57/10万人。
根据国际癌症研究署(IACR)的估计,2018年全球肺癌新发病例209.39万人,是新发病例最 多的癌症种类,经过年龄标准化的年发病率分别为31.5/10万人(男)和14.6/10万人(女)。根据85%占比推算2018年全球非小细胞肺癌新发病例约177.98万人,年发病率为26.8/10万人(男)和12.4/10万人(女)。
国内竞争分析
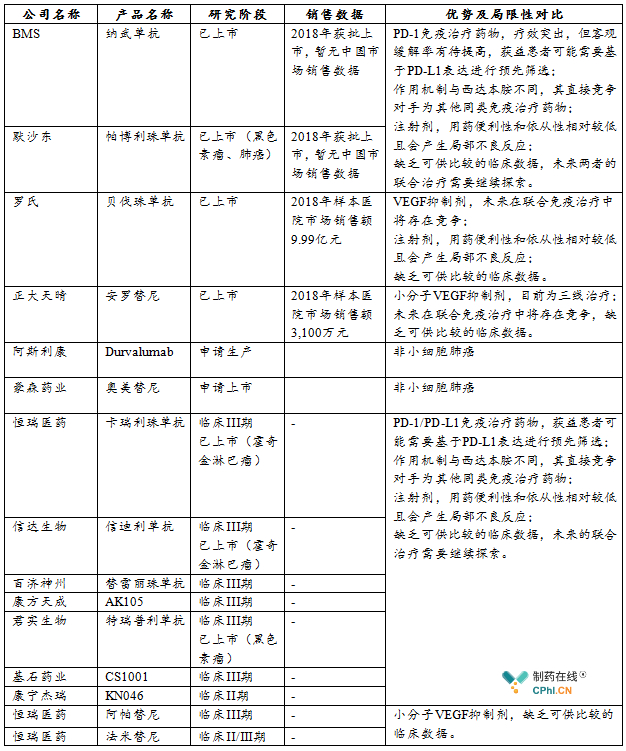
针对晚期非小细胞肺癌,如果存在驱动基因(EGFR、ALK、ROS)突变,临床指南推荐选用特定靶向治疗药物。西达本胺的主要竞争药物为其它没有明确驱动基因突变的晚期非小细胞肺癌患者的治疗药物。在过去的临床治疗中,此类患者首选化疗药物组合,VEGF抑制剂贝伐珠单抗可以联合化疗作为一线治疗方案。非小细胞肺癌治疗药物近几年进展显著,包括针对EGFR、ALK、ROS等基因突变的靶向激酶抑制剂在国际国内都有获批上市产品,包括阿法替尼、奥西替尼、克唑替尼等。2018年以来,国内批准了2款PD-1抗体药物帕博利珠单抗、纳武单抗以及1个小分子VEGF抑制剂安罗替尼,分别用于一线联合用药治疗、二线单药治疗和三线单药治疗,其它PD-1或PD-L1抗体和小分子VEGF抑制剂也处于不同的临床研究阶段。
国内已批准的或进入临床II、III期及已上市的针对同一适应症的主要竞争药物情况如下:
弥漫性大 B细胞淋巴瘤
西达本胺联合R-CHOP(利妥昔和四种化疗药的联用)在DLBCL的临床II期试验登记号为NCT02753647,32名DLBCL患者入组(患者年龄中位数是67岁)。对于16名可评价的患者中,CR=87.5%, ORR=93.8%。结果展示了西达本胺联合R-CHOP作为中高风险的老年DLBCL患者一线疗法,令人鼓舞的反应率和良好的耐受性。
弥漫大B细胞淋巴瘤(DLBCL)占非霍奇金淋巴瘤(NHL)的30%-40%,而且R-CHOP一直是DLBCL治疗的金标准。
针对弥漫性大 B细胞淋巴瘤适应症准备开展III期临床试验。也是微芯生物本次发行募资的主要用途之一。
美国获批的HDAC抑制剂
除前文提及的罗米地辛和贝利司他外,还有2006年FDA批准的Merck的Zolinza(Vorinostat,伏立诺他),作为皮肤T细胞淋巴瘤(CTCL)的三线疗法;2015年2月美国FDA批准诺华公司的Farydak(Panobinostat,帕比司他),和硼替佐米及地塞米松联用治疗多发性骨髓瘤(且之前至少接受过两次的治疗)。
参考资料:
Tucidinostat plus exemestane for postmenopausal patients with advanced, hormone receptor-positive breast cancer (ACE): a randomised, double-blind, placebo-controlled, phase 3 trial. Lancet Oncol. April 26, 2019.
Wind数据库 & CDE
微芯生物招股说明书(上会版)
西达本胺片(CXHS1300047)审评报告



合作咨询
![]() 肖女士
肖女士
![]() 021-33392297
021-33392297
![]() Kelly.Xiao@imsinoexpo.com
Kelly.Xiao@imsinoexpo.com
 2006-2025 上海博华国际展览有限公司版权所有(保留一切权利)
沪ICP备05034851号-57
2006-2025 上海博华国际展览有限公司版权所有(保留一切权利)
沪ICP备05034851号-57