PD-1/PD-L1抗体等免疫检查点抑制剂(ICB)大获成功,使科学界和产业界的注意力重新回到如何利用免疫系统来消灭癌细胞这一问题上。
ICB通过靶向受体或配体检查点蛋白(如PD-1/PD-L1、CTLA-4)阻断免疫抑制肿瘤信号,恢复抗肿瘤免疫应答。大量试验表明,与多种实体瘤的标准疗法相比,不管是单独用药,还是联合用药,ICB抗体都被证明在客观缓解率和生存期方面有显著提高。然而,不可忽视的是,大部分患者并不响应ICB。此外,目前ICB治疗时控制成功的免疫介导的肿瘤细胞消除的因素尚不完全清楚,且科学家们仍在继续研究能够预测肿瘤响应ICB的明确生物标志物。
不过,有证据表明,ICB在肿瘤浸润淋巴细胞(TILs)水平高、突变负担高以及PD-L1表达增加的肿瘤中,益处,也就是抗癌作用最强。这些响应性肿瘤被称为免疫学上的“热肿瘤”;与之相对的是缺乏响应的“冷肿瘤”。研究显示,这些“冷肿瘤”无法被ICB治疗主要归因于缺乏肿瘤相关抗原(TAAs)表达和/或呈递、TILs密度低、抑制性免疫细胞亚群(如中性粒细胞、巨噬细胞、调节性T细胞、髓源性抑制细胞和自然杀伤细胞)浸润,以及免疫抑制物质(如IL-10、indoleamine-2,3-dioxygenase、CD73、PD-L1和prostaglandin E2)表达。
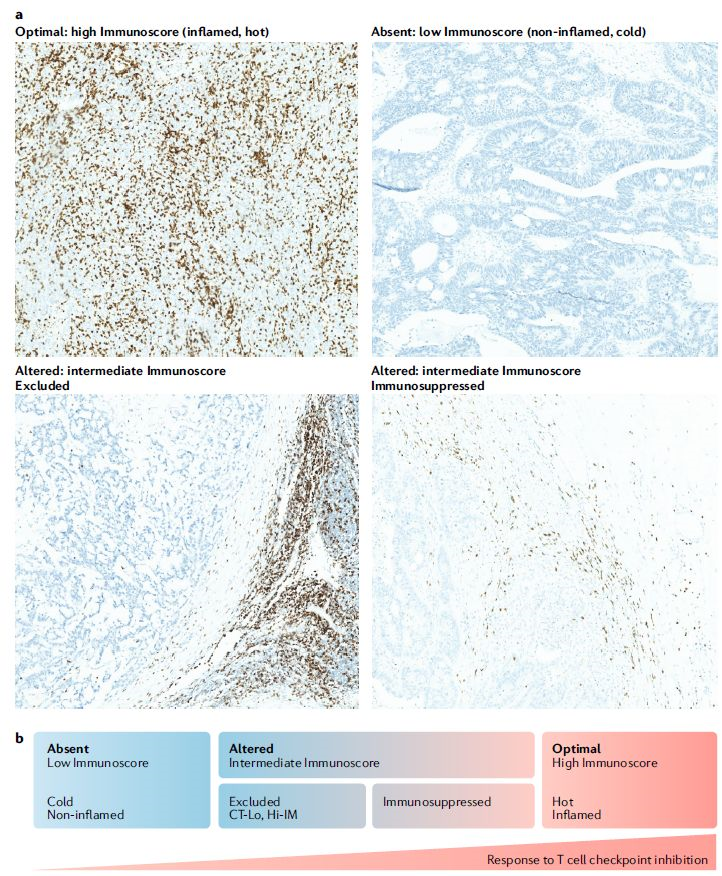
尽管新出现的数据拓宽了我们对肿瘤生物学以及ICB诱导的抗肿瘤免疫反应的理解,但旨在恢复T细胞抗癌功能的第二代免疫调节剂(immune-modifying agents)并没有提供基于临床前研究所预期的可重复的持久临床益处。这些第二代免疫调节剂包括靶向肿瘤坏死因子受体家族成员(如OX40、4-1BB、GITR)的激动剂抗体,以及靶向肿瘤微环境(TME)中免疫抑制通路(如indoleamine-2,3-dioxygenase、arginase 1)的化合物。
基于这些现状,业界开始寻找解决ICB耐药性的下一代治疗方案,目标是创造免疫学上的“热肿瘤”。其中,溶瘤病毒(Oncolytic viruses,一类能够优先感染和杀死癌细胞的病毒)代表了用于增强患者和某些肿瘤类型对ICB响应的一种理想治疗途径,因为这类病毒具有自我复制的能力,且可通过多种机制介导抗肿瘤活性。尽管关于溶瘤病毒如何与ICB最有效地结合仍有很多需要了解,但它们能够被用于促进淋巴细胞招募,诱导PD-1/PD-L1表达以增加肿瘤对ICB的反应及逆转耐药性;此外,它们还可被用于改变抗肿瘤免疫反应的其它组成。
不断积累的研究表明,溶瘤病毒的作用机制包括直接裂解肿瘤、调节肿瘤微环境、募集TIL、启动CD8+T细胞和先天免疫细胞介导的免疫反应,以及调节血管(如抑制肿瘤血管生成)。溶瘤病毒还能够促进免疫原性细胞死亡,这会进一步导致危险相关分子模式的释放,从而吸引先天免疫细胞(尤其是树突状细胞)到肿瘤中,并导致肿瘤微环境中肿瘤特异性T细胞的招募和成熟。
溶瘤病毒选择性感染和杀伤肿瘤细胞可自然发生,如,通过增强肿瘤细胞对抗病毒/抗菌信号通路(如,由细胞核酸传感器cGAS- STING、RIG-I、MDA5和Toll样受体介导的信号通路)的敏感性。此外,通过直接基因改造溶瘤病毒以去除在正常细胞中复制所需要的基因(这些基因并不是病毒在肿瘤细胞中复制所需的)也可限制其宿主范围,从而选择性靶向肿瘤。
不过,尽管一系列武装和非武装(armed and non-armed)溶瘤病毒的这种选择性靶向肿瘤的特性已被验证,但不管在临床前,还是在临床上,这些病毒单独用药时的疗效始终有限。
到目前为止,仅一种溶瘤病毒在美国和欧洲同时被批准上市,即,安进公司用于治疗晚期黑色素瘤的T-VEC。T-VEC是一种基于单纯疱疹病毒1型(HSV-1)的溶瘤病毒,被改造优先靶向肿瘤细胞。这种特异性是通过删除编码ICP34.5的基因RL1,ICP34.5的缺失可阻止病毒在正常细胞中复制。同时,开发者们还通过使病毒表达人类粒细胞-巨噬细胞集落刺激因子(GM-CSF)来刺激或增强抗肿瘤免疫反应。
将病毒学、癌症生物学和免疫学交叉起来的T-VEC的上市显著推动了这类溶瘤病毒的发展。大量研究显示,利用能够增强溶瘤病毒免疫介导活性或使它们诱导新型免疫调节模式到肿瘤微环境中的转基因武装它们,有望大大增强肿瘤对ICB的响应,尤其是免疫学上的“冷肿瘤”。溶瘤病毒有限的**以及它们可调节肿瘤微环境的能力为其与其它具有互补作用机制的抗癌疗法联合提供了诱人的机会。
7月10日,发表在Nature Reviews Drug Discovery上的一篇综述中,来自英国癌症研究所和阿斯利康肿瘤研发部的5位科学家讨论了溶瘤病毒疗法的发展,旨在优化这类疗法创造“热肿瘤”的能力,以及指导未来的联合治疗。
一、病毒选择
由于大多数溶瘤病毒作为单药缺乏持久的响应,目前业界的研究重心集中在提高溶瘤病毒的抗肿瘤疗效。选择一款溶瘤病毒及它的联合搭档需要考虑许多因素(图1)。
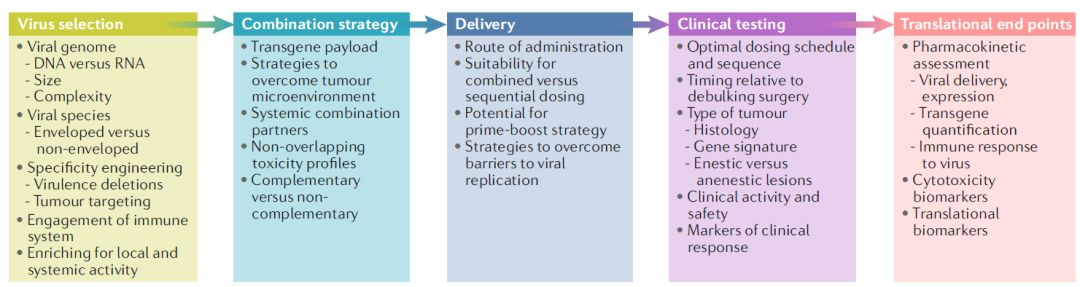
图1 | 溶瘤病毒作为肿瘤免疫工具箱的一部分
溶瘤病毒的基因组可由单链或双链RNA或DNA组成,具有不同的结构、基因组织、表达策略以及复制机制(表1)。此外,病毒家族可能在它们的裂解能力、诱导先天和适应性免疫反应的能力以及包装转基因的能力方面存在差异。虽然许多溶瘤病毒被基因改造具有肿瘤特异性,但也有一些未经修饰的溶瘤病毒已经进入临床试验,如呼肠孤病毒(reovirus)、柯萨奇病毒A21 和HF10(表2)。
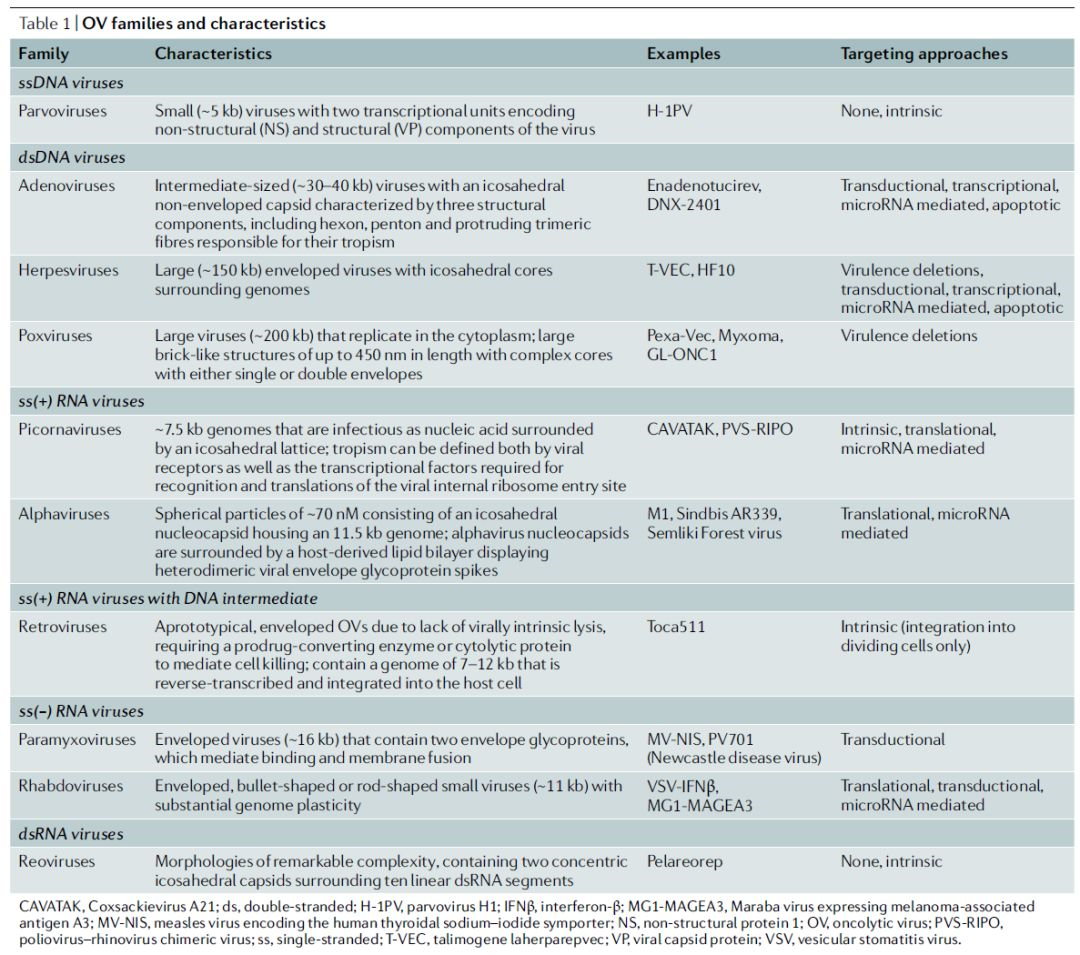
表1 | 溶瘤病毒家族及其特征
另一方面,虽然肿瘤细胞的基因和蛋白表达谱可能提供一定程度的固有溶瘤选择性,但许多方法已被用来进一步提高溶瘤病毒的肿瘤特异性。
大多数病毒能够被设计成编码外源基因。然而,RNA病毒通常具有更小的基因组和更有限的包装能力,DNA病毒(如HSV和牛痘病毒)通常有更大的基因组,在不削弱病毒复制的情况下更容易操作,并可容纳更大的转基因或多基因。此外,得益于高保真DNA聚合酶,DNA病毒可能具有更好的基因组完整性,并可能代表了更稳定的药物产品。
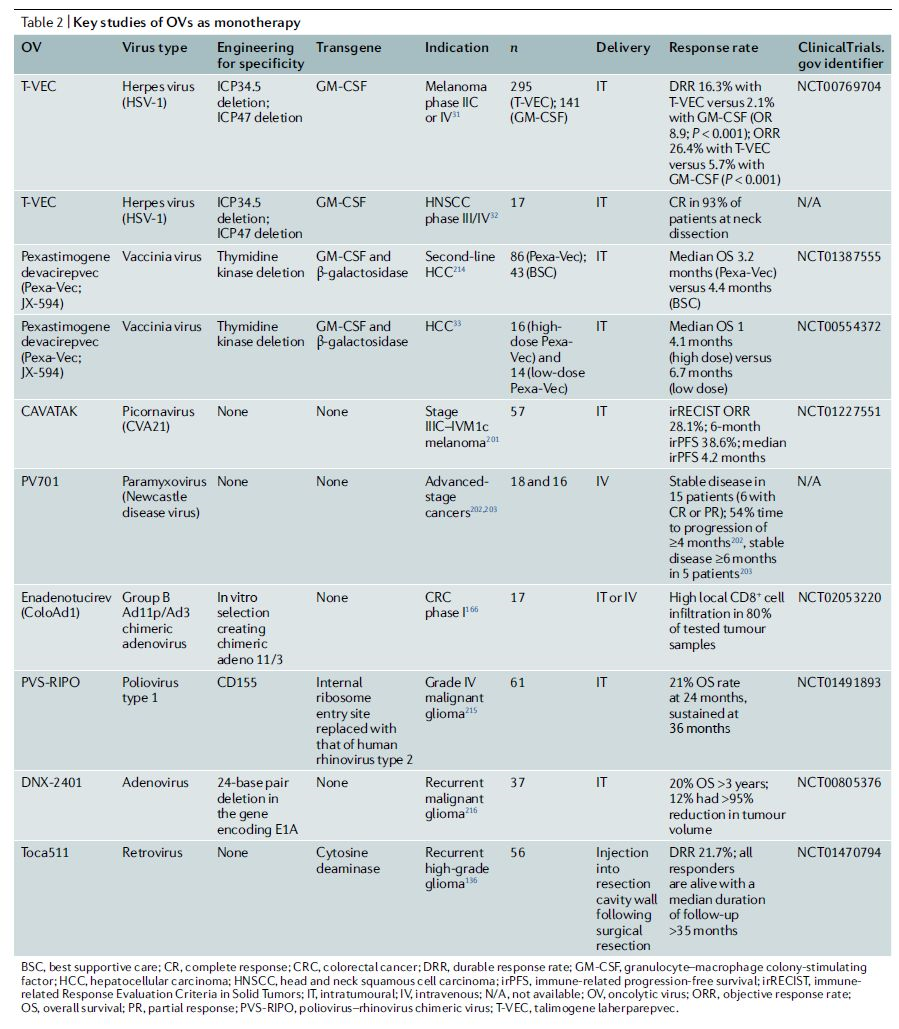
表2 | 溶瘤病毒作为单药的关键研究
二、作用机制
虽然一些研究已经证实,溶瘤病毒能够通过直接的肿瘤裂解以及间接诱导全身抗肿瘤免疫来发挥其抗肿瘤作用,但每种作用对整体疗效的相对重要性目前仍不清楚。通过对大量野生型以及基因工程病毒的研究,安全有效的溶瘤病毒越来越多;这些病毒表现出了不同的肿瘤倾向、裂解能力、诱导先天和适应性免疫反应的能力,以及包装能力。
除了肿瘤选择性,基因工程改造溶瘤病毒的另一个重要考虑是在裂解潜能和刺激抗肿瘤适应性免疫反应的能力之间找到平衡,以确保肿瘤在产生用于创造更合适的肿瘤微环境的免疫调节分子前不被裂解。
在决定用转基因武装溶瘤病毒或将溶瘤病毒与其它疗法联合前,除了需要理解病毒固有的裂解能力以及免疫调节能力,需要考虑的其它因素还很多,包括作用部位、治疗所需时间以及成本。对原发肿瘤样本的进一步分析将提供对肿瘤微环境内基线免疫浸润的深入理解,且可能在未来用于指导特定溶瘤病毒的武装策略或合理的联合治疗(图2)。
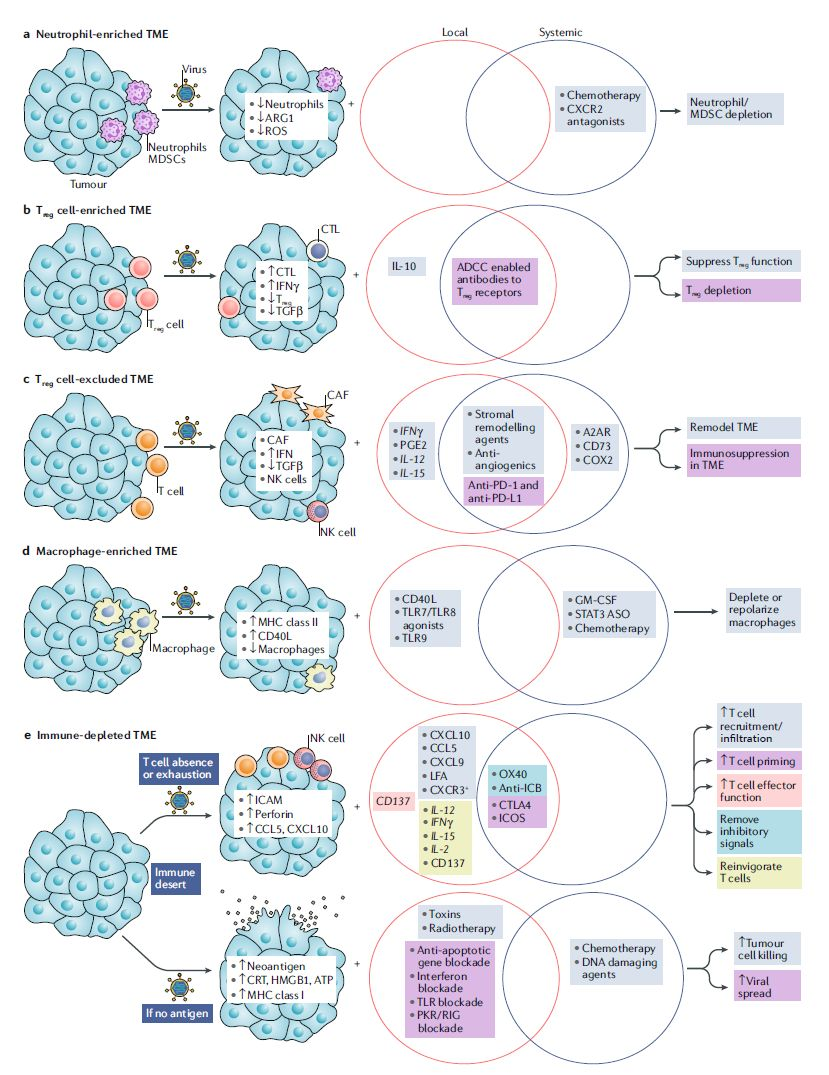
图2 | 设计局部与系统联合策略,以增强溶瘤病毒的活性
三、联合策略
临床上进展最快的溶瘤病毒联合治疗方案是与PD-1/PD-L1抗体的联合(表3),初步数据显示前景可观。溶瘤病毒+CTLA-4抗体、TIM3抗体或LAG3抗体的联合方案也在被评估中。此外,用多种细胞因子武装的溶瘤病毒也被用于与CAR-T细胞疗法联合;在异种移植瘤模型中,这种联合策略增强了抗肿瘤活性。
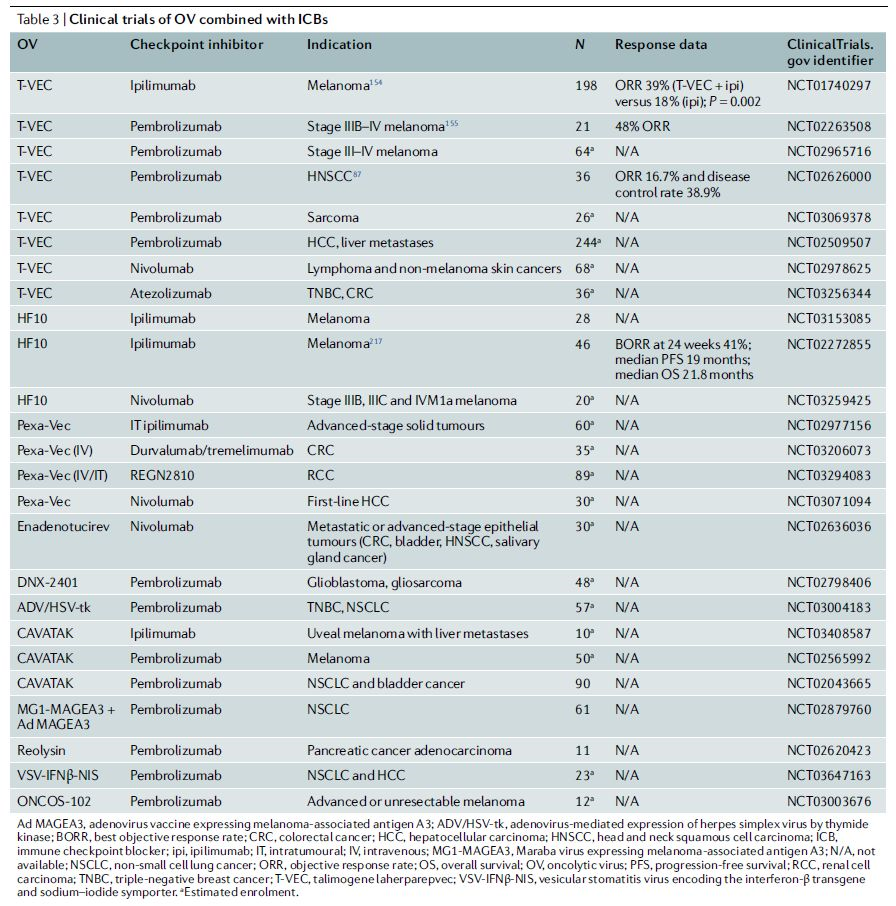
表3 | 溶瘤病毒联合ICB的临床试验
四、武装策略
为了驱动强有力的适应性免疫反应,使溶瘤病毒表达双特异性T细胞衔接分子(CD3和TAA)是一种可尝试的武装方法。有研究证实[5-6],这类溶瘤病毒在原发性体外患者样本和体内异种移植模型中显示出了溶瘤作用,以及通过招募和激活细胞**T细胞而导致的免疫介导的抗肿瘤作用。
五、克服体内响应障碍
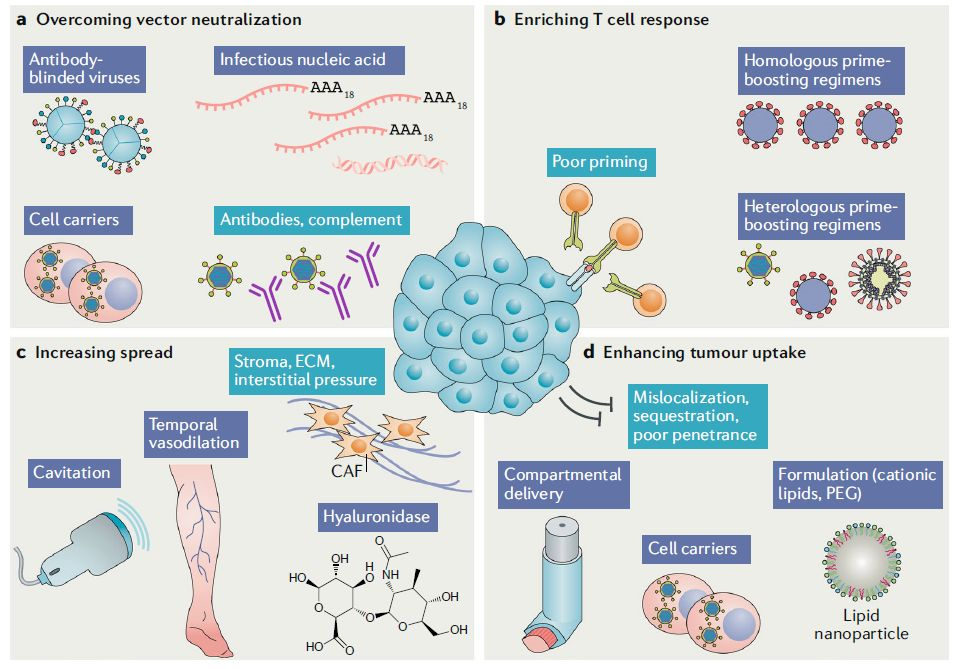
图3 | 克服体内响应障碍
除了用以提高靶向性和疗效的武装和联合策略,一些其它方法也可以用于克服溶瘤病毒的体内响应障碍(图3)。抗载体抗体(antivector antibodies)的存在阻碍了许多溶瘤病毒的全身给药,为了解决这一难题,一些科学家提出了使用细胞载体让溶瘤病毒“搭便车”的策略,这些细胞具有荷瘤组织趋向性,而溶瘤病毒可以藏在其中。举例来说,临床研究表明,外周血单核细胞可作为溶瘤病毒的载体。
六、递送途径
溶瘤病毒的有效性依赖于用足够数量的病毒感染目标肿瘤细胞,使其裂解并将溶瘤病毒扩散到邻近的肿瘤细胞。溶瘤病毒的剂量-反应关系很难预测,部分是因为其具有自我复制能力。虽然迄今为止大多数研究采用局部给药(瘤内、腹腔内或颅内)(表4),但溶瘤病毒的多种递送方法正在被研究。最终,对晚期转移性疾病的有效治疗可能需要系统性给药。
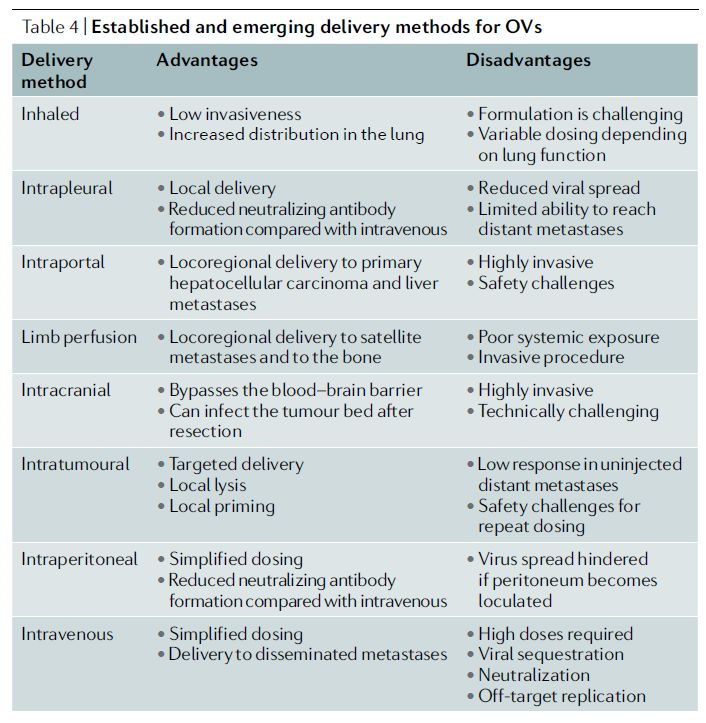
表4 | 溶瘤病毒已有和正在发展的递送方法
1、瘤内递送
瘤内递送是目前最常见的溶瘤病毒给药途径,最明显的优点是有利于病毒直接进入肿瘤,从而避开了系统的稀释、抗载体免疫力的攻击以及被扣押在脱靶位置,降低了在非目标细胞中复制的风险。值得一提的是,有研究证实[7],尽管基于这种递送策略的溶瘤作用可能只发生在被注射了溶瘤病毒的肿瘤部位,但当诱导出足够的系统性免疫反应时,抗肿瘤免疫响应也可能发生在未被注射的病变区域。
2、静脉注射
静脉递送是一种更简单、更受肿瘤医师欢迎的给药途径,因为这种给药方式可以使药物进入多个转移部位,而且符合许多肿瘤疗法给药的标准实践。此外,静脉输注溶瘤病毒具有极大的方便和安全效益。然而,一些研究显示,目前,溶瘤病毒静脉注射还未取得成功,因为受被稀释、被中和抗体快速清除、停留在非目标器官和/或病毒无法通过肿瘤血管渗出等因素的影响,静脉注射需要更多的病毒颗粒。
3、腹腔内递送
腹腔内递送能够使病毒定位到更大的腔室。尽管与静脉给药类似,腹腔内给药路径也可能会导致溶瘤病毒分布不良,以及病毒被快速清除,但已有的一项研究显示[8],腹腔内递送比静脉治疗更能限制病毒的系统性生物分布,导致了显著更长的总生存期。
4、其它递送途径
递送溶瘤病毒的其它途径还包括孤立肢体灌注、颅内递送、气溶胶递送(Aerosoldelivery)、成骨递送、动脉内灌注、门静脉递送、超声空化(图3)等。
七、疗效评估
生物标志物(病毒DNA或蛋白质等)或成像技术有望被用于评估溶瘤病毒的疗效,提供溶瘤病毒是否导致目标肿瘤位置的相关信息、肿瘤被杀伤的情况,以及溶瘤病毒是否调节了肿瘤微环境(“冷”肿瘤是否变成了“热”肿瘤)。

图4 | 评估药物动力学活性的潜在生物标志物
八、总结
到目前为止,溶瘤病毒的发展已有一百多年,从直接使用野生病毒进行研究,到选择性地改造野生病毒的基因组,使之特异性地在肿瘤内复制;再到让溶瘤病毒携带各种外源性基因以增强其疗效,这类疗法取得了可观的进步。
近几年,T-VEC的成功上市以及ICB疗法在大部分患者中耐药性的存在将溶瘤病毒的发展推向了新的“高潮”。科学家们越来越认识到,溶瘤病毒具有独特的免疫调节作用,有望增强ICB的治疗潜能。目前,有多项试验在评估溶瘤病毒+ICB的联合策略。究竟溶瘤病毒能否真的为癌症免疫疗法“添把火”,期待进一步数据的验证。



合作咨询
![]() 肖女士
肖女士
![]() 021-33392297
021-33392297
![]() Kelly.Xiao@imsinoexpo.com
Kelly.Xiao@imsinoexpo.com
 2006-2025 上海博华国际展览有限公司版权所有(保留一切权利)
沪ICP备05034851号-57
2006-2025 上海博华国际展览有限公司版权所有(保留一切权利)
沪ICP备05034851号-57