2019年07月16日,Astellas 和 Seattle Genetics联合宣布向FDA递交Enfortumab Vedotin上市申请,注册临床试验数据EV-201 (NCT03219333),申请适应症为PD-(L)1抗体或铂类化疗后复发局部晚期转移性尿路上皮癌患者!
根据WHO数据,尿路上皮癌新发病例逐年递增,2040年预计新诊断病例将会达到99万,相比2018年增约80%!目前,晚期尿路上皮癌的治疗手段非常有限,一线多为铂类化疗,近年,PD-(L)1抗体为代表的肿瘤免疫疗法的出现给铂化疗进展患者带来了更多选择,但是该疾病仍旧有着巨大的临床需求,尤其是PD-(L)1抗体治疗后复发患者!
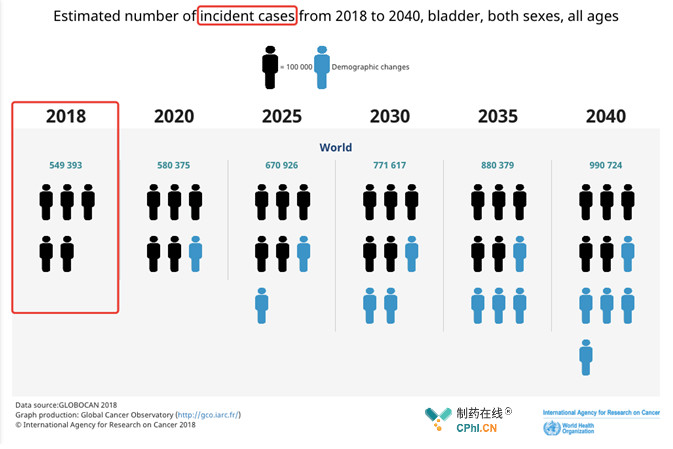
Graph production: Global Cancer Observatory (http://gco.iarc.fr/)
Enfortumab Vedotin是全球首款靶向Nectin-4的抗体偶联药物,Nectin-4在多种实体瘤中高表达,Enfortumab是安斯泰来利用Xenomice发现的Nectin-4单抗,利用Seattle Genetics独特的抗体偶联技术偶联monomethyl auristatin E (MMAE)!Enfortumab Vedotin已获得FDA突破性疗法认定,获批上市将会给铂类化疗或PD-(L)1抗体治疗后复发局部晚期转移性尿路上皮癌患者带来新的选择!
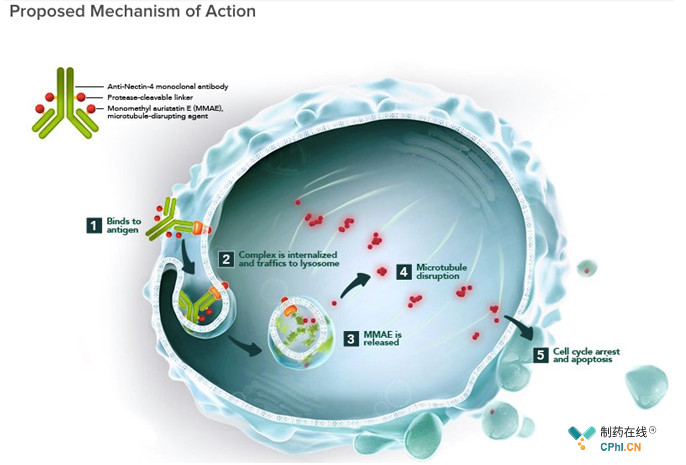
本文关注Enfortumab Vedotin注册临床试验,关注Enfortumab Vedotin整体项目开发进展。
一. Nectin-4:表达于多种组织
Nectin-4在人体各个组织中的表达量,见下图,因此该款药物也有着拓展至其他实体瘤的潜力。
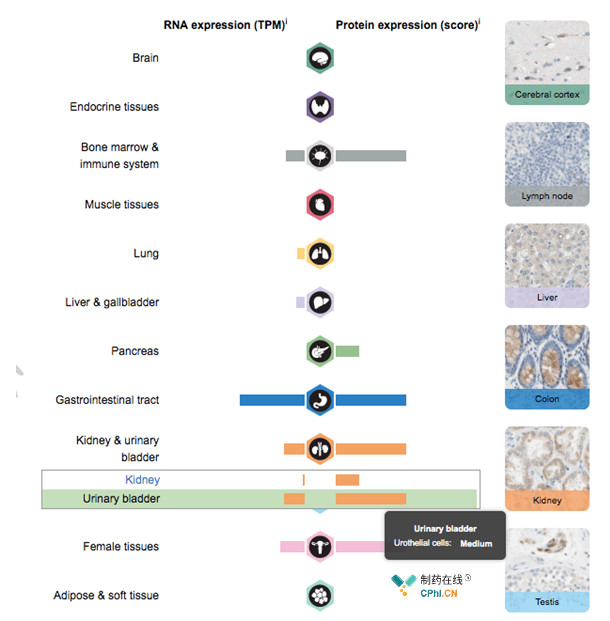
www.proteinatlas.org
二. Enfortumab Vedotin注册临床试验数据:EV-201 (NCT03219333)
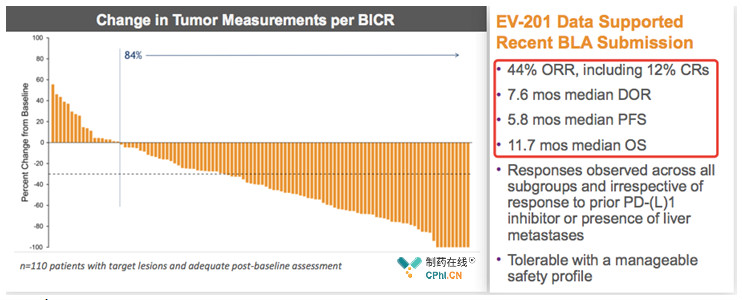
2019年ASCO年会中,Enfortumab Vedotin公布EV-201 (Cohort 1)关键临床试验数据。
Seattle Genetics
EV-201 (NCT03219333)数据显示,无论患者是否出现PD-(L)1抗体耐药或是肝 脏转移,Enfortumab Vedotin均能给患者带来良好应答,ORR 44%, 其中完全缓解率 12%; 中位DOR 7.6月;中位PFS 5.8月;中位OS,11.7月。
三. Enfortumab Vedotin:从尿路上皮癌拓展到其他实体瘤
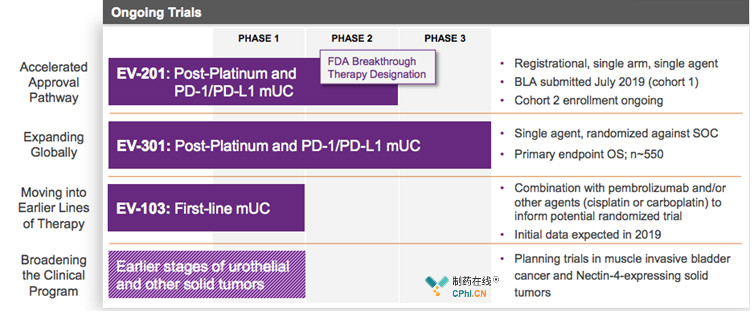
Enfortumab Vedotin是Nectin-4靶点的先行者和探界者,官方公布的Enfortumab Vedotin开发计划中能够看出:
1. 率先凭借EV-201亚组数据完成上市,获批用于PD-(L)1抗体或铂类化疗后复发局部晚期转移性尿路上皮癌患者;
2. 凭借EV-301,完成药物的全球注册申报;
3. 凭借EV-103,拓展适应症,获批用于一线治疗;
4. 拓展至早期膀胱癌或是其他实体瘤适应症。
Seattle Genetics是抗体偶联药物开发的佼佼者,公司成功将两款抗体偶联药物推向市场,Enfortumab Vedotin将会是公司第3款开发上市的药物,药物获批上市将会给尿路上皮癌的临床治疗带来新的临床治疗方案!
附:Enfortumab Vedotin
CAS: 1346452-25-2
Enfortumab序列信息:

资料来源:WHO INN
偶联linker:maleimidecaproylvalyl-citrullinyl-p-aminobenzylcarbamate (mc-val-cit-PABC)
偶联药物:monomethylauristatin E (MMAE)
DAR:3 - 4
作者简介:1°C,医药行业从业人员,希望自己的专业文字会越来越有温度,医药知识能够服务更多人,打破信息知识的壁垒!



合作咨询
![]() 肖女士
肖女士
![]() 021-33392297
021-33392297
![]() Kelly.Xiao@imsinoexpo.com
Kelly.Xiao@imsinoexpo.com
 2006-2025 上海博华国际展览有限公司版权所有(保留一切权利)
沪ICP备05034851号-57
2006-2025 上海博华国际展览有限公司版权所有(保留一切权利)
沪ICP备05034851号-57