众所周知,肺癌是发病率和死亡率增长最快,对人群健康和生命威胁的恶性肿瘤之一。“高发病率”、“五年生存率低”几乎一度成为肺癌的特征词,每年死于肺癌的人数约为176万,相当于你读完这篇文章的3分钟里,就有10人会因为肺癌而去世(图1)。回顾2009-2015的病例,肺癌的五年生存率仅为19.4%。
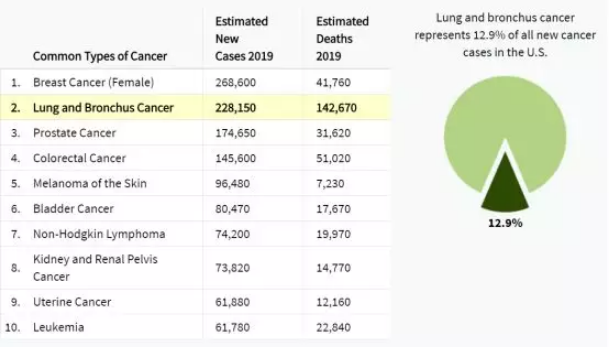
图1:2019年癌症新增病例数与死亡人数预测
值得一提的是,在一个世纪前,肺癌曾一度被认为是一种“罕见病”,因为旧一代的医者对这种疾病的极度不了解,肺癌往往被误诊为肺结核。直至上世纪40年代末期,新诊断的肺癌病例数开始飙升,肺癌变为“流行病”,并“流行”至今。过去肺癌病例的“罕见”可能与诊断技术的欠发达有关,但仍无法解释肺癌的危险因子。
烟草与肺癌
肺癌与空气污染的相关性研究在上个世纪的研究从未间断。在上世纪60年代,英国皇家医师学会和美国医疗总监分别发表报告,向大众普及了烟草的潜在危害。吸烟的男性患肺癌的可能性是不吸烟者的23倍,女性吸烟者患非吸烟者的可能性是非吸烟者的13倍。总体而言,美国80%至90%的肺癌被认为是由吸烟引起的。
纵观25年来美国肺癌新增与死于的病例数(图2),不难发现,在美国,吸烟率自报告发布后出现下降,而肺癌发病率也出现了成比例的减少。烟草的控制功不可没。
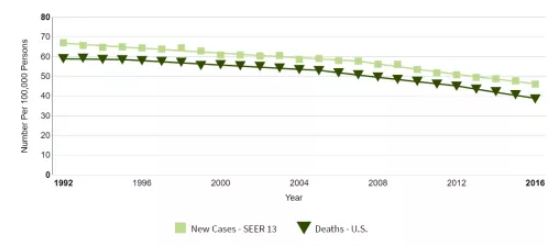
图2:1992年-2016年肺癌新增与死于的病例数
基因与肺癌
时至今日,相信大多数人都意识到吸烟与肺癌之间的密切联系。然而,我们仍然听到这样的声音,
“我的叔叔吸了60年,一辈子没有患肺癌。”
“我的姨妈从不吸烟,为什么却得了肺癌!”
是的,不吸烟者确实也会患上肺癌,尽管吸烟仍然是导致这种疾病的主要原因。那么除了烟草,还有哪些因素会导致人们罹患肺癌呢?
与许多其他癌症的发病机制相似,肺癌是由于致癌基因的激活或肿瘤抑制基因的失活引发的。如:K-ras原癌基因的突变导致大约10-30%的肺腺癌;EML4-ALK酪氨酸激酶融合基因突变;表皮生长因子受体(EGFR)调节细胞增殖,凋亡,血管生成,与肺癌侵袭相关。
但现阶段的化学疗法(主要是铂类双联体)仍是非致癌基因驱动晚期NSCLC的标准治疗方法。然而,患者通常需在疾病进展时接受多系列化疗。
近年来治疗方法有所改善,但对患者而言,治疗收益仍尚欠,只有一小部分患者可从后期治疗中获益。上世纪七十年代至上世纪末,肺癌患者的生存率没有明显的改善(图3)。
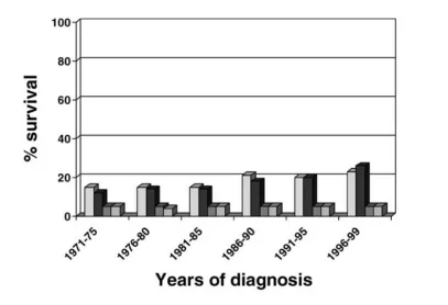
图3:上世纪末期肺癌患者的生存率
白:男性1年生存率;黑:女性1年生存率;深灰:男性5年生存率;浅灰:女性5年生存率
世纪之交,随着医药工作者在分子生物学领域研究的不断加深,对于组织学延伸研发的新型靶向治疗的研究在近10年间出现爆发式增长(图4)。靶向治疗是一种使用药物或其他物质攻击特定癌细胞的治疗方法。与化学疗法或放射疗法相比,靶向疗法对正常细胞的伤害通常较小。
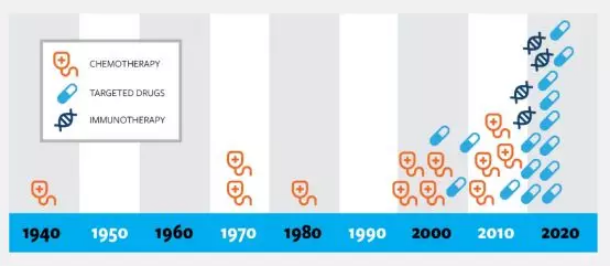
图4:抗癌药物研发数目图
EGFR抑制剂
随着分子生物学的快速发展,让我们得以从更为微观的角度去理解肺癌。不少研究发现,许多非小细胞肺癌(肺癌中的一种,约占总病例的85%)都与一种叫做EGFR的蛋白质有关。
EGFR蛋白的发现始于70年代。该蛋白的发现者亦是发现人类医学史上首个确认的生长因子—神经生长因子(NerveGrowthFactor)的诺奖获得者StanleyCohen教授。
他在耄耋之年常常感叹:“我不曾想到EGFR蛋白的科研发现,在日后会开启肺癌精准治疗的大幕。而这一发现,只是缘起于实验小鼠提前睁开的双眸,缘起于我对幼雏孵化机制的好奇。”
在纯化神经生长因子的过程中,Cohen教授在小鼠唾液腺的分泌物中,发现了另一神奇因子的端倪,这种因子能让新生小鼠提前睁开双眼、长出乳牙。终于,他与团队终于证实了表皮生长因子(epidermalgrowthfactor,EGF)的存在。随后通过后续实验,Cohen教授团队发现了这个可以与EGF结合的跨膜糖基受体——具有酪氨酸激酶活性的EGFR。
50%-80%的NSCLC患者中都存在EGFR过表达,EGFR过表达与癌细胞不受控的生长与不良预后相关。EGFR突变与肺癌发病机理的关系使之成为靶向治疗的主要候选分子。EGFR靶向抑制剂可以通过细胞膜并在癌细胞内起作用,阻断癌细胞生长和分裂所需的信号。
第一代EGFR靶向抑制剂研发由此起步,第一代EGFR抑制剂吉非替尼(Gefitinib),厄洛替尼(Erlotinib)和埃克替尼(Conmana)应运而生,肺癌治疗也正式宣告进入靶向疗法时代。肺癌患者中位生存期从4个月提升到40个月以上。
值得关注的是,这些靶向疗法的早期临床结果显得“参差不齐”。比如对于NSCLC患者来说,吉非替尼作为二线疗法所带来的中位总生存期(OS)为5.6个月,与安慰剂对照组的5.1个月并没有显著差别。但当我们用现代医药知识来看这个问题时,这实际上反映了癌症患者精准治疗的重要性。对于EGFR基因拷贝数较高的患者,药物缓解率为37.5%,远高于对照组的2.6%。所以对于明确存在EGFR突变的患者,其无进展生存期与缓解率也要显著高于化疗对照组。关于厄洛替尼的类似研究也反映了同样的治疗效果结论。
为了进一步提高疗效,医药工作者们随即开发出了第二代EGFR抑制剂,阿法替尼(Gilotrif)与达可替尼(Dacomitinib)就是其中的代表。与第一代EGFR抑制剂不同,这些药物可以实现靶点结合的不可逆性,因此有望更有效地抑制肿瘤的发展。在无进展生存期的比较上,第二代EGFR抑制剂确实展现出了更优的疗效。
不过第一代和第二代EGFR抑制剂,都面临了同样的耐药性问题,在接受EGFR抑制剂治疗后,大约50%的患者会出现EGFRT790M突变,导致药物耐受性的出现。
阿斯利康研发的第三代EGFR抑制剂奥西替尼(Osimertinib)似乎又带给了我们新的希望,在带有EGFR突变的初治患者群体中,该药的无进展生存期中位数为18.9个月,几乎是第一代EGFR抑制剂数据的2倍(10.2个月)。但猝不及防的是,第三代药物相伴的C797S耐药突变也随之出现。
就在本月,正大天晴在研新药TQB3804在中国即将率先步入1期临床试验,它不仅能克服第三代EGFR抑制剂耐药后产生的两大类常见三重突变,更能抑制EGFR野生突变和前二代靶向药物引发的T790M突变。该药物有望成为破解C797S耐药突变的第四代EGFR靶向抑制剂。
ALK抑制剂
EGFR抑制剂为肺癌靶向疗法吹响了嘹亮的号角。后续不断有新的创新疗法崭露头角。间变性淋巴瘤激酶(Anaplasticlymphomakinase,ALK)作为NSCLC新兴的生物标记物和治疗靶标,最近得到众多关注。
在NSCLC患者中,大约有5%的患者带有ALK基因重排变异。这一比例虽然不高,但NSCLC患者中的ALK重排常见于年轻非吸烟腺癌患者。ALK是位于2号染色体上胰岛素受体家族的一员,编码跨膜受体酪氨酸激酶,可驱动肿瘤生长。
由辉瑞公司生产的第一代ALK抑制剂克唑替尼(Crizotinib)于2011年被FDA批准用于治疗晚期肺癌。对82例ALK诱发肺癌患者的初步I期试验的早期结果显示,患者总体反应比率为57%,8周控制率为87%,6个月的无进展生存率为72%。2014年,二代ALK抑制剂Ceritinib被FDA批准用于治疗ALK阳性转移性NSCLC患者,这些患者已经进展或对克唑替尼不耐受。
2018年,辉瑞宣布FDA批准该公司研发的第三代ALK抑制剂Lorbrena上市,用于治疗ALK阳性转移性NSCLC患者。此药不仅能治疗对其他ALK抑制剂产生耐药的患者,还可以穿透血脑屏障,带来了48%的缓解率。
VEGF抑制剂
癌细胞在复制期间产生一种称为血管内皮生长因子(VascularEndothelialGrowthFactor,VEGF)的物质,它会导致新血管形成(血管生成)并加速癌症生长。VEGF抑制剂可以阻止新血管形成,进而会杀死癌细胞,因为癌细胞需要新的血管补给的丰富营养才能生长。
此类VEGF抑制剂多与其他抗癌药物使用。
2006年,FDA批准贝伐单抗(Bevacizumab)联合卡铂/紫杉醇化疗用于一线晚期非鳞状NSCLC。该研究表明使用联合贝伐单抗治疗的患者的总体存活率提高了两个月。
2014年,FDA批准雷莫芦单抗(Ramucirumab)联合多西紫杉醇治疗转移性NSCLC。
免疫检查点抑制剂
除了上述的各种酶类抑制剂,最近大热的免疫检查点抑制剂治疗也在抗肺癌药物中大放异彩。提及免疫检查点,大家并不陌生,去年诺奖的获得者所研领域就是它。
某些类型的免疫细胞,如T细胞和一些癌细胞有一定的蛋白质,称为关卡蛋白(CheckpointProtein),其表面上保持免疫反应的检查。当癌细胞含有大量这些蛋白质时,它们不会被T细胞攻击和杀死。免疫检查点抑制剂阻断这些蛋白质,帮助T细胞增强杀死癌细胞的能力。此类药物已被用于治疗一些晚期NSCLC患者。在免疫疗法问世前,晚期NSCLC患者的5年平均生存率仅为5.5%。而在免疫疗法的治疗下,患者的总生存率可以达到18%!
2016年4月,罗氏公司的阿特珠单抗(Tecentriq)已被FDA授予快速通道肺癌药物,加速了药物审批过程。同年10月,FDA批准阿特珠单抗用于转移性NSCLC患者的治疗。今年4月,FDA扩大此药适用症,批准阿特珠单抗与卡铂和依托泊苷联合用于广泛期小细胞肺癌(ES-SCLC)患者的一线治疗。此药是唯一一个获批用于NSCLC一线疗法的PD-(L)1单抗。同时也是20多年来ES-SCLC患者初次获得新的一线治疗选择。
其实除了阿特珠单抗,还有一位全能型的PD-1抑制剂药物——派姆单抗(Keytruda):
2016年10月,FDA批准派姆单抗作为PD-L1高表达(>50%)的转移性NSCLC患者的一线疗法;
2017年5月,FDA批准派姆单抗与培美曲塞和卡铂联用,作为转移性非鳞状NSCLC一线疗法;
2018年8月,FDA批准派姆单抗与培美曲塞和铂类化疗联用,作为无EGFR/ALK基因突变的转移性非鳞状NSCLC患者的一线治疗;
2018年10月,FDA批准派姆单抗与卡铂和紫杉醇联用,用于转移性鳞状NSCLC患者的一线治疗;
今年3月,NMPA批准派姆单抗与化疗联用用于晚期非鳞癌肺癌患者的一线治疗方法,成为首个在国内上市的免疫联合方案。
值得一提的是,截至目前,派姆单抗已经全部覆盖肺癌适应症,同时一线疗法也仅剩NSCLC尚未攻破,相信这将是派姆单抗抗肺癌之战斗的最后一城。据了解,派姆单抗广泛期小细胞肺癌验证性3期临床试验KEYNOTE-604仍在进行中,后续临床进展仍旧值得长期关注。
在2019年6月4日,EvaluatePharma?发布《WorldPreview2019,Outlookto2024》,预测在2024年,派姆单抗全球销售额预计会突破170亿美元,5年复合增长率15%,同时将会取代修美乐荣膺下一代药王。预言究竟是否能成真,相信时间会给我们答案的。
最后的话
先有无数的基础生命科学研究者为医药研发奠定坚实的理论之路,后有医药开发者研发出为无数困于病痛的生命带来的希望之药。如同EGFR蛋白发现者,诺贝尔获得者Cohen教授儿时启蒙时所想那样。
那些看似毫无生机的蛋(Molecularmechanism),终将羽化成为怎样鲜活的生命(Life-savingdrug),让我们拭目以待!



合作咨询
![]() 肖女士
肖女士
![]() 021-33392297
021-33392297
![]() Kelly.Xiao@imsinoexpo.com
Kelly.Xiao@imsinoexpo.com
 2006-2025 上海博华国际展览有限公司版权所有(保留一切权利)
沪ICP备05034851号-57
2006-2025 上海博华国际展览有限公司版权所有(保留一切权利)
沪ICP备05034851号-57