Romosozumab于2019年1月8日获日本医药品医疗器械综合机构(PMDA)批准上市,且于2019年4月9日获美国食品药品管理局(FDA)批准上市,商品名为Evenity®。该药由安进和优时比共同研发,之后授权于安斯泰来用于绝经后骨质疏松症的共同开发与商业化权利。且在欧盟、加拿大也已提交了上市申请,用于治疗高骨折风险绝经妇女和高骨折风险男性的骨质疏松症。
1
Romosozumab简介
研发历程
2016年12月,基于2项关键性III期临床研究(FRAME和BRIDGE)的数据,在日本提交上市申请。其中,FRAME研究在绝经后女性骨质疏松症患者中开展,BRIDGE研究在男性骨质疏松症患者中开展。
2019年1月9日,在日本获批上市,商品名为EVENITY®,用于骨折高危老年男性和绝经后女性的骨质疏松治疗。
2016年9月,FDA受理romosozumab的上市申请。
2017年7月,FDA驳回了romosozumab的上市申请,要求把III期阳性对照 ARCH 研究新的安全性与有效性数据及 BRIDGE 研究的有效性与安全性数据整合到申请资料中。
2018年7月,再次向FDA提交上市申请。
2019年4月9日,在美国获批上市。
2018年1月,EMA受理romosozumab的上市申请。这项申请是基于关键性III期临床研究FRAME的积极数据。
2019年6月,EMA拒绝romosozumab的上市申请。
2
Romosozumab的临床数据
有效性:Romosozumab能够获批上市,主要依据其纳入超过11000名绝经后骨质疏松症女性患者和245名骨质疏松症男性患者的三项关键III期临床试验结果。
其中第1项试验(NCT01575834)是一项多中心、随机、双盲、安慰剂对照的III期临床试验,目的是评估romosozumab与安慰剂的疗效差异。共有7180名平均年龄为71岁(范围55-90岁)的绝经女性患者被随机分为两组,分别给予romosozumab(n=3581)或者安慰剂(n=3576)治疗,每月给药一次,共12个月。该试验结果显示:与安慰剂组相比,使用romosozumab治疗一年后,患者新发椎骨骨折的风险降低了73%,并且能使患者骨密度(BMD)显著增加,腰椎(12.7%)、髋关节(5.8%)、股骨颈(5.2%)。组织形态学评估结果显示,接受romosozumab治疗的患者在新骨形成和骨再吸收减少的同时,也能够增加骨量,骨小梁和皮层厚度。
第2项试验(NCT01631214)也是一项多中心、随机、双盲的III期临床试验,目的是评估romosozumab与阳性对照药阿仑膦酸钠的疗效差异。共有4093名平均年龄为74岁(范围55-90岁)的绝经女性患者被随机分为两组。Romosozumab组(n=2040),第1年每月给药一次romosozumab,然后再继续使用阿仑膦酸钠继续治疗1年。阳性对照药阿仑膦酸钠组(n=2014),单独使用阿仑膦酸钠治疗2年。结果显示:与单独使用阿仑膦酸钠2年组相比,使用romosozumab治疗1年后再使用阿仑膦酸钠继续治疗1年可使新发椎骨骨折的风险降低50%;并且能使患者骨密度(BMD)显著增加,腰椎(8.1%)、髋关节(3.8%)、股骨颈(3.8%)。
第3项BRIDGE试验(NCT02186171)评估romosozumab与安慰剂在骨质疏松症男性患者的疗效差异。将245名骨质疏松症男性患者以2:1的比例随机分配romosozumab(n=163)或相应的安慰剂(n=82),每月给药一次,持续治疗12个月。结果显示,与安慰剂组相比,romosozumab治疗12个月使骨质疏松症男性患者的脊柱和髋部骨密度显著增加。
不良反应:最常见的不良事件包括关节痛,头痛,肌肉痉挛,外围水肿,乏力,颈部疼痛,失眠,皮肤感觉异常等。
3
SO靶点概述
硬化蛋白sclerostin(SO)是由骨细胞产生的糖蛋白,其SOST基因位于染色体17q12-q21上用于骨硬化蛋白的分泌。硬化蛋白是经典Wnt信号传导通路的关键抑制剂,其能与LRP-5/6结合并阻止Wnt与Frizzled家族受体和LRP共同受体结合,从而下调经典的Wnt信号通路。因此,硬化蛋白能够抑制骨细胞的分化和功能,从而减少骨形成。
Romosozumab是一种靶向骨硬化蛋白(Wnt信号通路抑制剂)的人源化IgG2单克隆抗体,通过与骨硬化蛋白结合,拮抗其活性,阻断sclerostin-LRP-5/6通路,从而促进新骨形成并减少骨吸收。
4
全球上市及临床在研的SO靶点药物
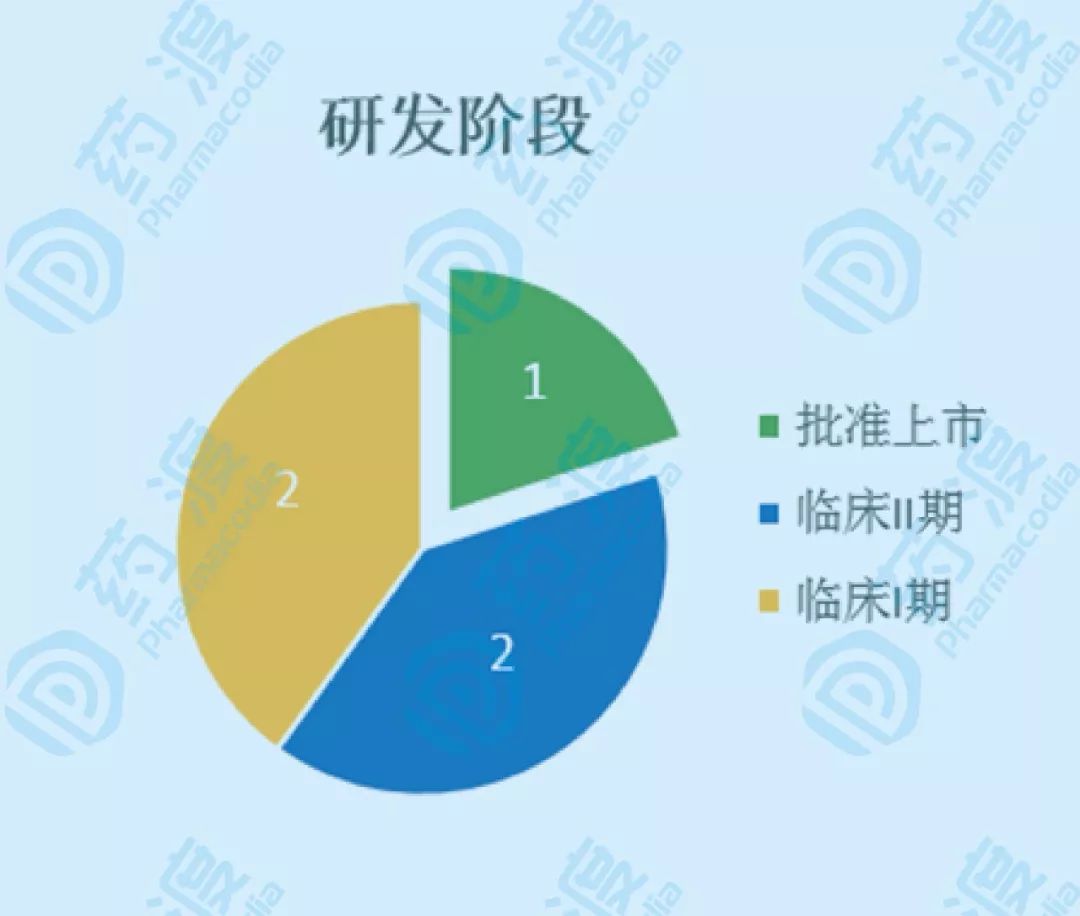
图 按研发阶段统计SO靶点药物数量
表 全球上市及临床在研的SO靶点药物.
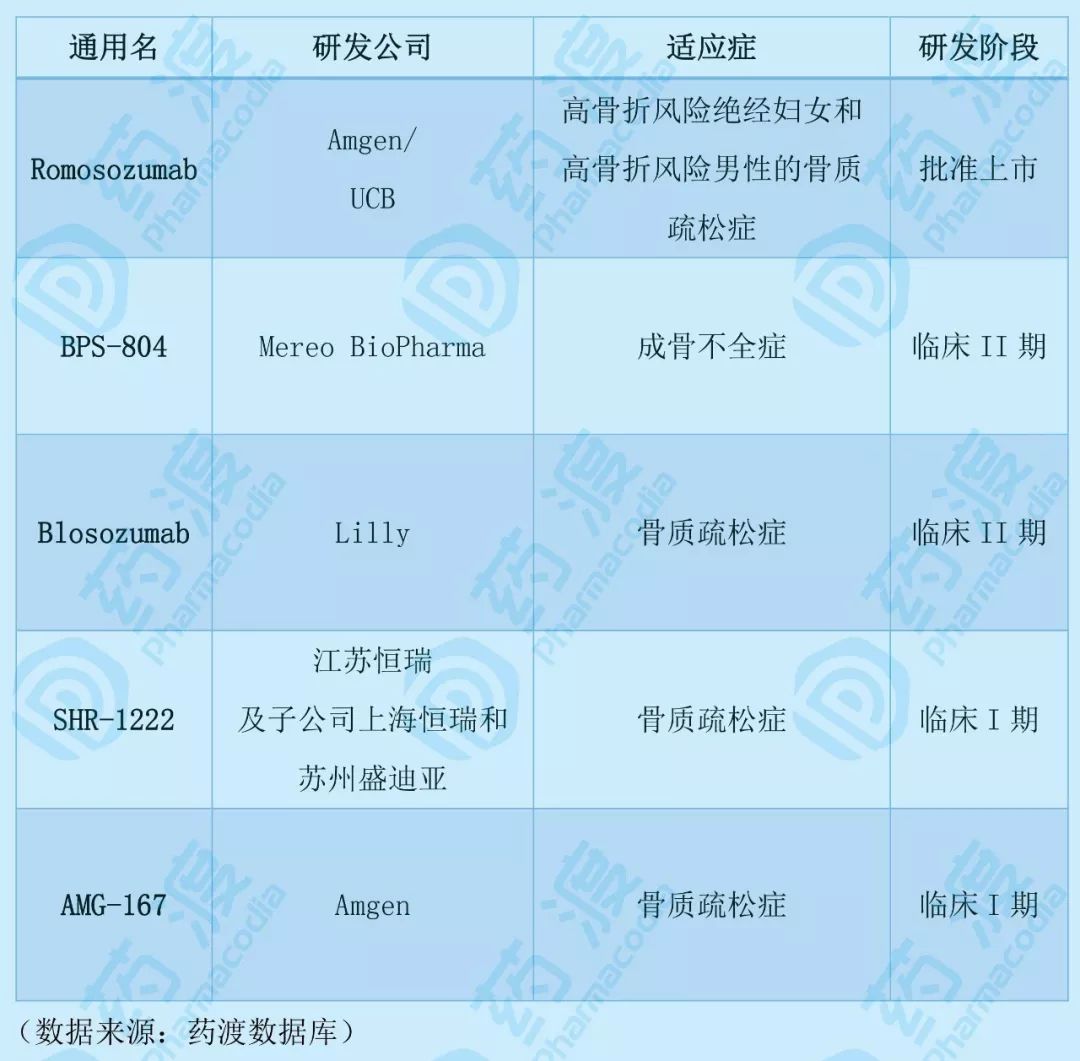
目前仅有1个可作用于SO靶点的药物获批上市。Romosozumab作为首款靶向SO骨硬化蛋白的人源化IgG2单克隆抗体,其上市之路并非一帆风顺。2017年7月,FDA拒绝romosozumab在美国上市,此次拒绝批准上市申请主要是担心患者出现严重心脏或循环系统(例如心脏病发作或中风)的风险会增加。之后应FDA要求,Amgen和UCB补充了III期阳性药对照ARCH研究以及在男性骨质疏松患者中进行的BRIDGE研究的数据,延长了其审评期限,直到今年4月才获批上市。但今年6月欧盟CHMP拒绝了romosozumab的上市申请。此次,也是第二次被监管机构拒绝,同样是因为romosozumab在增加心血管风险方面的硬伤,也导致该药在2024年预计销售额仅有3.2亿美元。
此外,还有4个靶向SO骨硬化蛋白的临床在研药物,包括2个处于临床II期的BPS-804和blosozumab,2个处于临床I期的SHR-1222和AMG-167。
BPS-804(setrusumab)用于治疗成骨不全症(OI)。OI是一种罕见的遗传性疾病,其特征是骨量低下、骨骼脆性增加和反复骨折,主要是由多种致病基因突变导致的。BPS-804是一种靶向于硬化蛋白的全人源IgG2型单克隆抗体,可抑制硬化蛋白(抑制骨形成细胞活性的蛋白)的功能,用于成骨不全症的治疗,目前处于临床II期研究阶段。
Blosozumab是由礼来研发用于治疗骨质疏松症的创新生物药。今年3月28日,创胜集团 (Transcenta Holding) 正式宣布其全资子公司奕安济世生物药业与礼来签署合作协议,获得了礼来在骨病治疗领域开展一系列创新生物药产品线的独家开发授权,其中包括了处于临床II期的blosozumab,这也使其有望明年在中国进入临床试验。
SHR-1222是唯一一款由国内企业(江苏恒瑞医药股份有限公司及子公司上海恒瑞医药有限公司、苏州盛迪亚生物医药有限公司)研发的SO靶点生物制品1类新药,目前正在开展I期临床试验。
5
药渡观点
骨质疏松症是一种以骨量低下,骨微结构破坏,导致骨脆性增加,易发生骨折为特征的全身性骨病。其与年龄相关性高,人口老龄化程度越高,患病人数越多。目前我国是骨质疏松患者数量最多的国家,骨质疏松患者人数约有9000万,约占总人口的7%,并且至少2.1亿人的骨量低于正常值。骨质疏松症是一种慢性病,我国在该领域的慢病患病人群基数大,且近年来患病率不断增加。因此,治疗骨质疏松症药物的市场空间非常可观。
目前研发靶向SO抗骨质疏松药物的企业较少,仅有安进,Mereo BioPharma,礼来和恒瑞医药四家药企。面对国内药企日趋白热化的竞争,恒瑞医药利用其丰富的在研产品管线,在治疗骨质疏松慢病领域进行了前瞻性布局,其极具潜力的SO靶点新药—SHR-1222就是的体现。



合作咨询
![]() 肖女士
肖女士
![]() 021-33392297
021-33392297
![]() Kelly.Xiao@imsinoexpo.com
Kelly.Xiao@imsinoexpo.com
 2006-2025 上海博华国际展览有限公司版权所有(保留一切权利)
沪ICP备05034851号-57
2006-2025 上海博华国际展览有限公司版权所有(保留一切权利)
沪ICP备05034851号-57