2019年3月20日Solriamfetol hydrochloride获美国FDA批准上市,用于治疗嗜睡症或阻塞性睡眠呼吸暂停(OSA)成人患者的白天过度嗜睡(EDS),商品名为Sunosi®,由爵士制药上市销售。Solriamfetol hydrochloride是一款口服小分子药物,用于嗜睡症患者的剂量为75 mg和150 mg,每日一次,OSA患者的剂量为37.5 mg、75 mg和150 mg。Sunosi®是第一款双效多巴胺-去甲肾上腺素再摄取抑制剂(DNRI)用于治疗嗜睡症或OSA成人EDS患者。笔者采用药渡数据库梳理了DNRI药物的研发情况,以期为我国这类药物的研发提供参考。
NO.1
Solriamfetol hydrochloride概述

图1. Sunosi®的基本信息
该药可以导致多巴胺和去甲肾上腺素水平上升,多巴胺可以直接刺激大脑中促醒的神经元,而去甲肾上腺素则可能通过作用于下丘脑腹外侧视前核,关闭睡眠驱动子。因此,这款新药可能通过双重机制来起到促进患者保持清醒的作用。Solriamfetol hydrochloride作为抑郁症辅助治疗的研究在美国停止。目前,与嗜睡症和OSA相关的过度嗜睡和与帕金森病相关的过度嗜睡临床研究正在加拿大和美国展开。目前未见在中国展开的临床研究。
研发关键事件:
Solriamfetolhydrochloride于2009年在美国展开嗜睡症患者白天过度嗜睡的临床I期试验,于2019年3月在美国获批。该药物最初由韩国SK生物制药研发,爵士制药于2014年1月获得该化合物的除韩国、日本等某些亚洲国家的全球开发、制造和商业化权利。历经10年时间,终成正果。具体里程碑事件见下图。
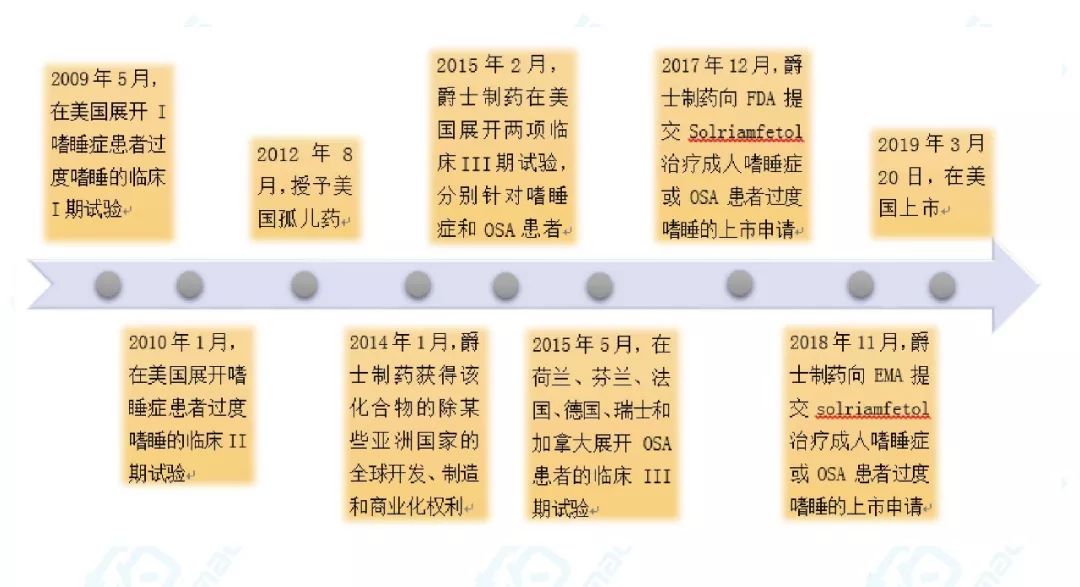
图2. Sunosi®研发关键事件
白天过度嗜睡(EDS)患者的特征是持续困倦并且缺乏能量。即使在长时间的夜间睡眠之后,患者也会不分时间或地点出现短暂性睡眠,例如开车、用餐或者谈话中。给患者的工作及生活带来了很大的影响。
临床常用的嗜睡评价方法有:
多次小睡睡眠潜伏期试验(MSLT):测试患者能够在多长时间入睡,是定量评价EDS严重程度的准确方法,重复性较好。
维持醒觉试验(MWT):测试患者能够在多长时间内维持清醒状态,受试者半躺,测试时间为40 min,主要用来评价嗜睡的改善情况。
Epworth睡眠评价量表(ESS):评价白天嗜睡程度。
临床数据:
Sunosi®的批准基于4项临床III期临床试验。
研究1(NCT02348593)和研究2(NCT02348606)均是为期12周的多中心、随机、双盲、安慰剂对照的临床研究,分别针对嗜睡症患者(239人)和OSA患者(476人),评估Sunosi®提高患者清醒程度和降低白天过度嗜睡的有效性。共同主要治疗终点均为给药12周后清醒维持试验(MWT)时间和Epworth嗜睡量表(ESS)评分相对基线的变化;次要终点是12周后患者总体印象量表(PGIc)评分,用于评估总体症状严重性的变化。
研究1结果显示,相比安慰剂组,150 mg用药组MWT明显降低7.7分钟,ESS评分下降3.8,也就是说150 mg 剂量Sunosi®明显提高了患者的清醒程度、降低了白天过度嗜睡情况,而75 mg用药组未见明显效果,同时用药组PGIc评分也优于安慰剂组;研究2结果提示,相比安慰剂,三种剂量(37.5 mg、75 mg、150 mg)Sunosi®的MWT分别降低4.5分钟、8.5分钟和10.7分钟,ESS评分分别下降1.9、1.7和4.5,可见Sunosi®明显提高了OSA患者的清醒程度,同时PGIc评分也优于安慰剂组。
研究3(NCT02348619)的受试者是174名OSA患者,该为期6周的多中心、双盲、安慰剂对照、随机停药临床试验的目的是评估Sunosi®的药效维持情况,结果提示用药组效果优于安慰剂组。
研究4(NCT02348632)是一项为期52周的开放性试验,针对638名患有OSA或者嗜睡症的受试者(进行过临床试验)评估Sunosi®的药效维持情况,结果显示,用药组各项指标(MWT、ESS和PGIc)均优于安慰剂组。
常见的不良反应是:头痛、恶心、食欲减退、失眠和焦虑。
“白天过度睡眠可能对患者的正常生活工作造成严重的影响,通过这项审批,我们为患者提供了一种可全天持续清醒的新型日间用药。”爵士制药首席执行官Bruce Cozadd这样说道,“这次FDA审批是爵士制药的一个重要里程碑,我们将继续为经常神经衰弱和睡眠障碍的患者提供新的治疗选择。”
NO.2
靶点介绍
多巴胺是大脑中含量最丰富的儿茶酚胺类神经递质,它能传递兴奋及开心的信息。去甲肾上腺素在化学结构上也属于儿茶酚胺,它既是一种神经递质,也是一种激素。
多巴胺转运蛋白(DAT)是一种跨膜蛋白,其生理作用为将突触间隙内已发挥生理效应的多巴胺重新摄入突触前膜,以备再次利用,同时终止神经细胞间的信息传递。DAT涉及许多与多巴胺相关的疾病,包括注意力缺陷多动障碍、双相情感障碍、抑郁和酗酒。
去甲肾上腺素转运蛋白(NET)是一种单胺转运蛋白,负责氯化钠依赖的细胞外去甲肾上腺素的再摄取。NET还可以再摄取细胞外多巴胺。这两种神经递质的再摄取对于调节突触间隙中的浓度必不可少。NET以及其他单胺转运蛋白是许多抗抑郁药的作用靶点。
多巴胺-去甲肾上腺素再摄取抑制剂是一类通过阻断多巴胺转运蛋白和去甲肾上腺素转运蛋白而抑制神经递质去甲肾上腺素和多巴胺再摄取的药物。导致去甲肾上腺素和多巴胺的细胞外浓度增加,因此肾上腺素能和多巴胺能神经传递增加。该类药物临床上主要用于治疗抑郁症、注意力缺陷多动障碍、嗜睡症和抗帕金森病等疾病。
NO.3
上市及在研药物
笔者在此只统计了双效多巴胺-去甲肾上腺素再摄取抑制剂,三重抑制剂不在此列。检索日期:2019年7月24日。
表1. 全球DNRI上市及在研药物
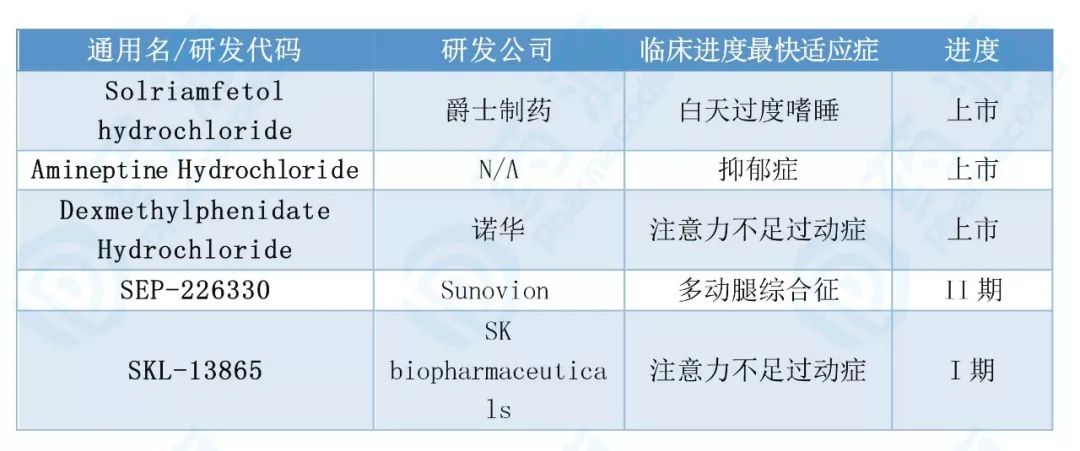
Dex** Hydrochloride(盐酸右哌甲酯) 由诺华研发,适用于注意缺陷多动障碍的治疗,于2001年11月13日获美国FDA批准上市,目前还在进行注意力不足过动症的临床IV期研究。2015年,河南中帅医药在中国展开了盐酸右哌甲酯缓释胶囊拟用于治疗注意缺陷多动障碍患者的临床研究,临床III期招募完成。这是国内仅有的一项DNRI临床试验。这为国内企业的DNRI布局提供了参考。
NO.4
药渡观点
目前,抗白天过度嗜睡的常用药物多为单一靶点药物,如**(莫 达非尼),双重DNRI药物Sunosi®的问世带来了一种新的药物机理,为全球药企布局提供了新视角。
DAT和NET均与抑郁症、注意力缺陷多动障碍、嗜睡症和抗帕金森病等疾病的发生关系紧密,因此,制药公司尤其是国内药企应当增加在DNRI领域的研发投入,开发更多的药物,为这类患者提供更多的治疗选择。



合作咨询
![]() 肖女士
肖女士
![]() 021-33392297
021-33392297
![]() Kelly.Xiao@imsinoexpo.com
Kelly.Xiao@imsinoexpo.com
 2006-2025 上海博华国际展览有限公司版权所有(保留一切权利)
沪ICP备05034851号-57
2006-2025 上海博华国际展览有限公司版权所有(保留一切权利)
沪ICP备05034851号-57