上个月底,艾维替尼在CDE临床试验又登记了一项临床I期试验(图1),引起了笔者的好奇,艾维替尼去年已经优先审评(图2),怎么又要开始进行I期试验?从试验方案编号中含有的"2014"可以推测,此次试验还是在2014年首次I期试验的基础上进行的。带着疑问,首先查看一下艾维替尼的审评进度(图3),2019年7月17日CDE化药临床一部的临床审评任务是补充资料任务(图4)。笔者不禁要问,艾维替尼为何开展了4个I期试验?
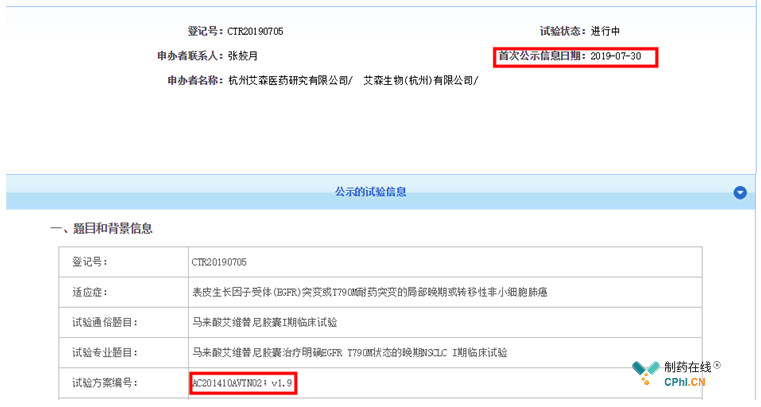
图1 艾维替尼CDE登记临床试验CTR20190705
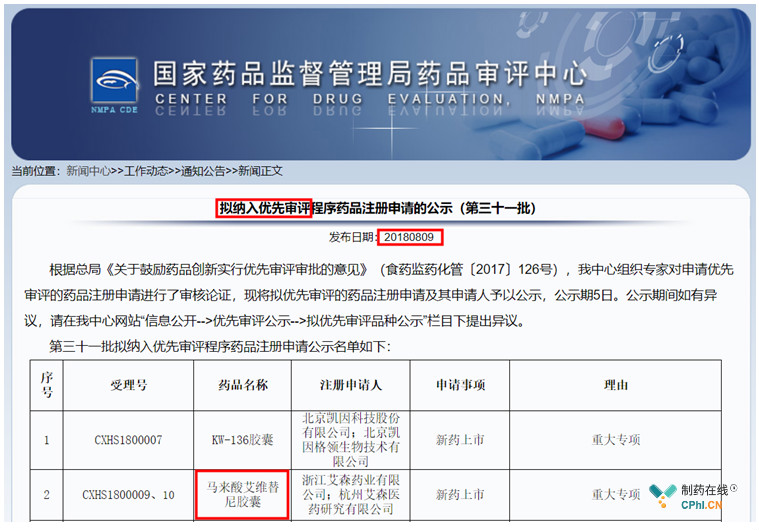
图2 艾维替尼纳入优先审评

图3 艾维替尼CDE审评总进度
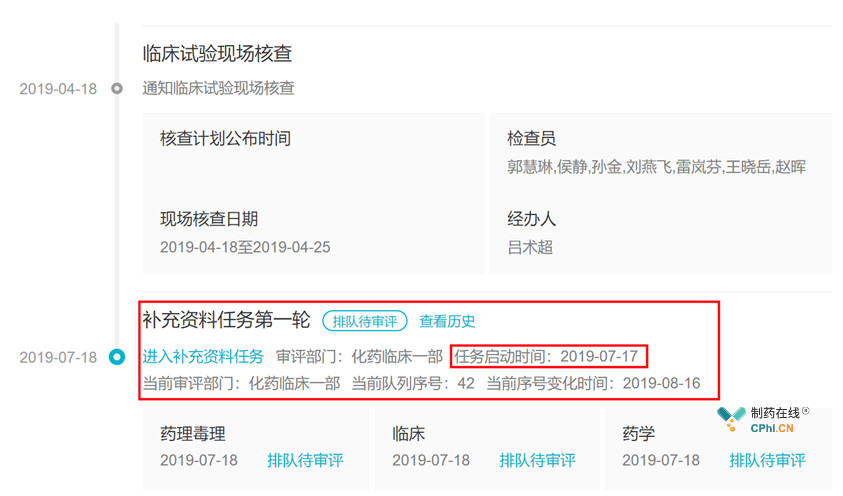
图4 艾维替尼最新进度(2019年8月16日更新)
(一) 艾维替尼介绍
根据艾森医药官网介绍,马来酸艾维替尼是由艾森自主研发的国内首个第三代EGFR抗肿瘤靶向抑制剂,拥有全球化合物专利,用于治疗具有EGFR突变或耐药突变的非小细胞肺癌。它是"十二五"国家重大新药创制重大科技专项支持的原创新药,于2014年9月获国家CFDA和美国FDA临床批件。2015年,艾维替尼分别在中国和美国启动Ⅰ临床研究,成为第一个进入中国临床研究并同步开展美国临床研究的自主创新药物。2016年初,中国已完成一百多例晚期肺癌病人的临床评估,进展非常顺利,初步结果令人鼓舞。美国的临床研究也在包括国际上的癌症研究中心--美国安德森癌症中心(MD Anderson Cancer Center)在内的四大癌症中心启动,进展也很顺利。2016年8月25日,马来酸艾维替获国家CFDAⅡ/Ⅲ期临床批件(批件号:2016L08001、 2016L08002 、2016L08003)。同时,艾维替尼已获得CDE的书面支持,确定了有条件批准的注册临床方案。2018年6月,向国家药监局提交了新药注册上市申请(NDA),8月被纳入优先审评程序,并已启动了美国、法国和西班牙等国际临床研究。[1]
艾森医药2016年9月14日官微介绍中国首个第三代表皮生长因子受体(EGFR)抑制剂艾维替尼(AC0010)的临床前研究成果。该成果在美国肿瘤主流期刊《Molecular Cancer Therapeutics》(《分子肿瘤治疗》)发表,通讯作者是中山肿瘤防治中心的张力教授。论文详细阐述了艾维替尼作为新一代EGFR抑制剂的系统临床前研究过程以及首次人体临床试验的初步结果。[2]
文章论证了艾维替尼分子结构设计的独特优势及成药的潜在可能性。通过系统的临床前研究,具有独特化学结构的艾维替尼体现了第一、二代EGFR抑制剂所不具备的三个重要抗肺癌的药理特征:
1、高选择性抑制导致肺癌的EGFR突变基因,而对具有生理功能的正常EGFR没有作用,其选择优势高达300倍。因而艾维替尼的副作用非常小。
2、克服肺癌EGFR基因的耐药突变,有效抑制耐药肺癌细胞的生长,从而克服肺癌耐药。
3、不可逆抑制肺癌EGFR突变基因,可永久性阻断EGFR突变基因的致癌通路,具有更好的治疗效果。
(二) 艾维替尼临床研发之路
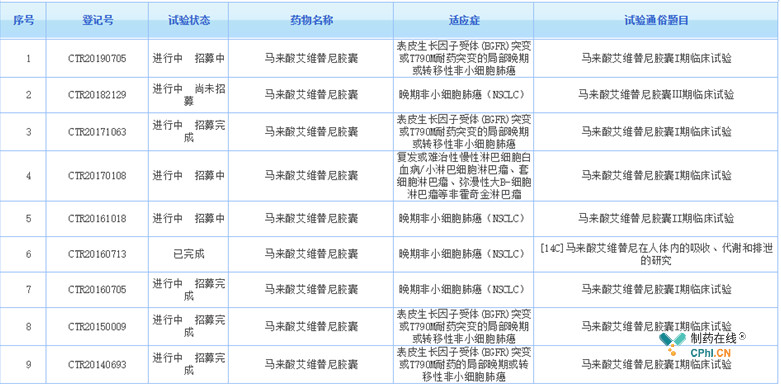
图5 艾维替尼CDE登记临床试验
(三) 艾维替尼临床试验结果
鉴于前期临床结果的疗效与安全性数据,艾维替尼被寄予厚望,被冠以"国产9291"的称号。
2019年第55届美国临床肿瘤学会(ASCO),由杭州艾森医药研究有限公司自主研发的中国首个第三代EGFR-TKI艾维替尼亮相年会,并展示了其治疗中国EGFR-T790M突变阳性的非小细胞肺癌患者的II期临床研究结果。艾维替尼推荐剂量 (300mg BID)治疗的200多例受试者中,90%靶病灶明确缩小,客观肿瘤缓解率 (ORR) 为52.2%(奥西替尼AURA17中国亚组ORR为59.7%)),疾病控制率 (DCR)为88.0%,中位疾病缓解持续时间 (DOR) 为7.64个月。安全性数据显示,艾维替尼治疗受试者报告的不良事件主要为1级或2级,最常见的药物相关等级3/4 AE(2%)是ALT增加(7.0%),AST增加(4.8%),腹泻(4.4%),间质性肺病(4.0%),中性粒细胞计数减少(3.5%),并且没有药物相关5级不良事件。[3]
(四) 笔者思考
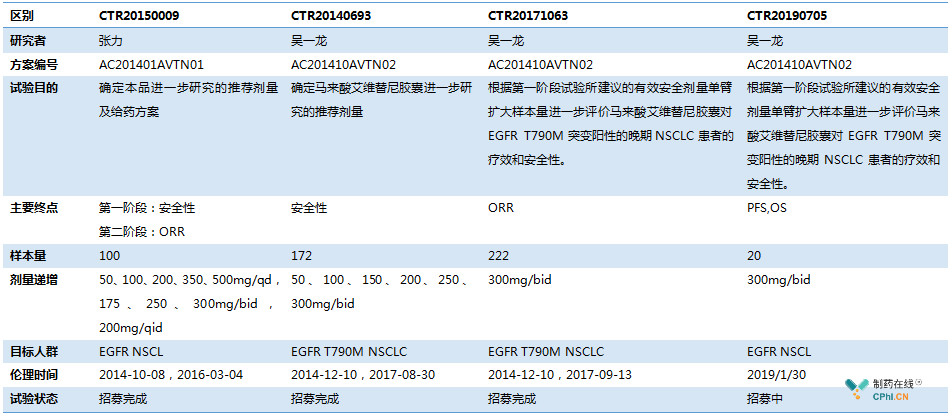
纵观艾维替尼开展的8个临床试验:三期1个,二期1个,14C试验2个,I期试验4个。I期试验主要异同点如下表。在2014年时分别在两个中心进行了剂量递增的剂量探索,共计进行了13个剂量组和3种给药频率的探索,最后将剂量选择为300mg/bid。这在笔者的从业经历来看剂量组数量之多是十分罕见的,
艾维替尼3个I期临床试验共计计划入组100+171+222=493人,在中国I期临床试验中也算是样本量非常大了。虽然现在倡导无缝设计,KEYNOTE-001试验也被奉为经典案例,入组例数上千。但是对于第三代EGFR抑制剂这种作用靶点和目标人群明确的药物,不知为何I期临床试验需要入组近五百例?期待未来参与艾维替尼的临床药理专家会在未来给大家分享艾维替尼的故事。
艾维替尼II期二线临床几近完成,并且获得国家优先审评,III期一线临床试验今年已经启动,2019年7月17日CDE化药临床一部的临床审评任务显示为补充资料任务的背景下,艾维替尼开展一项I期临床试验着实让笔者有几点好奇:1)I期样本量仅20人;2)研究终点还设为PFS和OS;3)入组的未EGFR NSCLC患者,一线二线均可。这样的I期试验设计十分罕见,试验目的说是为了进一步补充安全性和疗效数据。结合CDE的审评意见,如果是CDE让艾维替尼补充的这20例试验数据,那么等试验结果出来,艾维替尼上市时间可能得往后推迟至少一年了。在中国EGFR抑制剂竞争如此激烈的市场背景下,艾维替尼可谓是前途未卜。
我们都知道,奥西替尼对脑转移患者的疗效良好,虽然艾维替尼对脑部病灶有效,但是否能超越奥西替尼,艾森公司却从未正面宣传。虽然中国有十余个在研三代EGFR抑制剂,市场竞争十分激烈,对标奥西替尼这个优秀的也很有难度。作为中国医药人,压力可真是不小。
表1 艾维替尼I期临床试验汇总
参考文献
[1] 艾维替尼官网介绍:http://www.aceapharma.com/index.php?c=news&a=page&id=55
[2] 艾维替尼官微:抗肺癌新药艾维替尼临床前研究成果发表 https://mp.weixin.qq.com/s?__biz=MzA3ODMyODkzMw==&mid=2247483817&idx=1&sn=e120dfd16963cd42ab2559bf7c67b91a&mpshare=1&scene=
1&srcid=0817cxboilGV10MIKgkm8Rc4&sharer_sharetime=1566011057394&sharer_shareid=aee03b895ad55bf12520995e3c890bcf#rd
[3] 2019 ASCO abstract #9091: https://ascopubs.org/doi/abs/10.1200/JCO.2019.37.15_suppl.9091



合作咨询
![]() 肖女士
肖女士
![]() 021-33392297
021-33392297
![]() Kelly.Xiao@imsinoexpo.com
Kelly.Xiao@imsinoexpo.com
 2006-2025 上海博华国际展览有限公司版权所有(保留一切权利)
沪ICP备05034851号-57
2006-2025 上海博华国际展览有限公司版权所有(保留一切权利)
沪ICP备05034851号-57