今天(2019年8月22日),百济神州宣布美国FDA已受理泽布替尼用于治疗先前至少接受过一项治疗的套细胞淋巴瘤(MCL)患者的新药上市申请(NDA)并授予优先审评资格,处方药申报者付费法案(PDUFA)日期为2020年2月27日。FDA于今年早些时候授予泽布替尼针对该适应症的突破性疗法认定。
泽布替尼是一款由百济神州科学家自主研发的高效力、高选择性的BTK抑制剂,其设计旨在化BTK占有率、最小化脱靶效应,目前在多项B细胞恶性肿瘤中展现了成为新治疗方案的潜力。
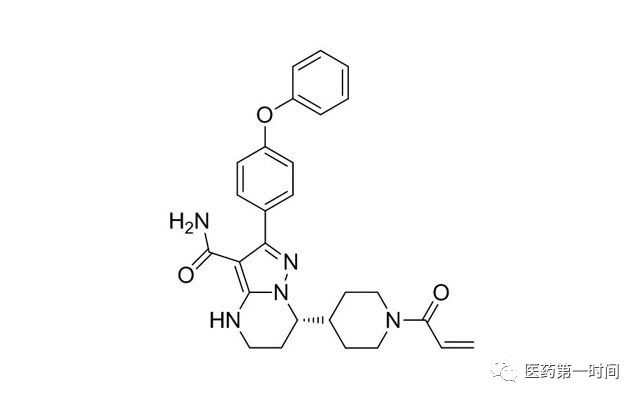
泽布替尼分子结构式
百济神州正在开展针对泽布替尼的广泛的全球临床开发项目,由八项3期或潜在的注册性临床研究组成,其中包括两项正在开展的头对头对比试验,作为单药和与其他疗法进行联合用药治疗多种淋巴瘤。目前,在所有项目中已有约1500位患者接受了泽布替尼的治疗。
此次提交的NDA是基于以下数据,包括在共计123位患者中开展的两项临床试验——一项泽布替尼用于治疗B细胞淋巴瘤患者的全球1/2期临床试验(clinicaltrials.gov登记号:NCT02343120)和一项在中国开展的泽布替尼用于治疗复发/难治性(R/R)MCL患者的多中心2期临床试验(clinicaltrials.gov登记号:NCT03206970);以及在五项临床试验中641位患者的安全数据以及非临床数据。
此前,美国FDA已授予泽布替尼用于治疗华氏巨球蛋白血症(WM)患者的快速通道资格以及用于治疗先前至少接受过一种治疗的成年MCL患者的突破性疗法认定。中国国家药品监督管理局(NMPA)药品审评中心(CDE)正在对泽布替尼用于治疗 R/R MCL 和 R/R 慢性淋巴细胞白血病(CLL)/小淋巴细胞淋巴瘤(SLL)的新药上市申请进行审评,两者均被纳入优先审评。



合作咨询
![]() 肖女士
肖女士
![]() 021-33392297
021-33392297
![]() Kelly.Xiao@imsinoexpo.com
Kelly.Xiao@imsinoexpo.com
 2006-2025 上海博华国际展览有限公司版权所有(保留一切权利)
沪ICP备05034851号-57
2006-2025 上海博华国际展览有限公司版权所有(保留一切权利)
沪ICP备05034851号-57