FDA在1992年设立“加速批准项目”(Accelerated Approval Program),很大程度上加快了一些新药问世的步伐。作为加速批准的条件,FDA也要求医药公司在加速获批后,保证对这些药物开展上市后临床研究。但按照法律要求如期开展的上市后临床试验,究竟有多少?
缺失的36%
本周,一项新发表于Manufacturing & Service Operations Management的研究,回顾了FDA要求开展的一系列临床试验,发现从1992年到2008年,在所有被要求开展上市后临床试验的药品中,36%从未做过上市后临床试验。50%的试验平均需要5年时间才能启动。
论文作者,来自内布拉斯加大学林肯商学院的Liang(Leon)Xu认为,药品获得加速批准的企业,有的并没有多少动因去做上市后临床研究。一方面,上市后临床研究不易开展,也存在成本高昂等因素。另一方面,撤销一种上市药品需要时间。如果没有证明药品无效的证据,就不能立即执行。
解读:加速批准是有条件批准
《1992年处方药生产商付费法案》(Prescription Drug User Fee Act of 1992)要求FDA设立加速批准通道。由于获得临床结果数据需要花费很长时间,通过加速批准通道上市的药品,允许基于一个替代终点先批准用于治疗严重疾病,满足未竟的医疗需求。按照法案规定,基于这类终点得到加速批准的药品,要开展上市后临床试验,证实预期的临床效益。如果上市后的确证性试验显示,确实具有临床获益,FDA将给予药物常规批准。如果上市后试验未能显示药物对患者具有临床获益,申请人没有尽职开展上市后临床研究,FDA的监管程序将有权撤销加速批准的药品或适应症。
如何促进开展上市后临床试验
《1992年处方药生产商付费法案》颁布后,FDA对加速批准的依赖逐渐加大,越来越多的药品通过加速批准上市。但即便不少上市后临床试验没有如期开展,监管机构对这些药品也不能简单地一撤了之。那么监管机构是否应考虑在有条件批准之前,就通过有效的手段,促使加速批准的药品生产商开展上市后临床试验?
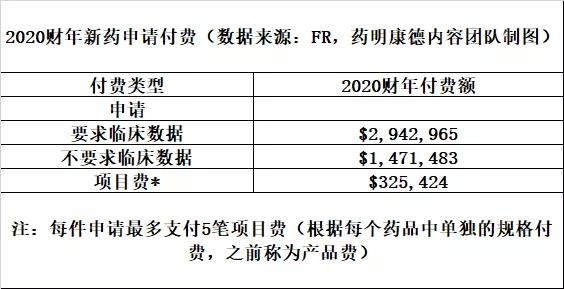
这篇论文的作者提出了一些建议。他们指出,可以对现有的新药申请付费制度做些改变,将现行的申请付费与上市后临床研究截止日期挂钩。用新的付费方式取代目前的付费方式,就可能利用现有的工具确保开展上市后临床研究。这笔费用将取决于药物成功上市的可能性,以及未经证实的药物从市场上撤市的可执行性。
参考资料
1. FDA. Prescription Drug User Fee Rates for Fiscal Year 2020.Aug 2, 2019.Retrieved Aug 31,2019 from https://www.federalregister.gov/documents/2019/08/02/2019-16435/prescription-drug-user-fee-rates-for-fiscal-year-2020
2. 21 CFR 314. Subpart H. Retrieved Aug 31,2019 from https://www.law.cornell.edu/cfr/text/21/part-314
3. Michael Cipriano. Golodirsen Rebuff: Did Exondys 51 Review Strife Influence US FDA's Decision? Aug 20, 2019. https://pink.pharmaintelligence.informa.com/PS140711/Golodirsen-Rebuff-Did-Exondys-51-Review-Strife-Influence-US-FDAs-Decision
4. FDA. Accelerated Approval. Retrieved Aug 31, 2019 from https://www.fda.gov/patients/fast-track-breakthrough-therapy-accelerated-approval-priority-review/accelerated-approval
5. New Research Reports Over One-third of Pre-Approved Prescription Drugs Have Not Completed the FDA Approval Process. Retrieved Aug 31, 2019 from https://www.informs.org/About-INFORMS/News-Room/Press-Releases/New-Research-Reports-Over-One-third-of-Pre-Approved-Prescription-Drugs-Have-Not-Completed-the-FDA-Approval-Process



合作咨询
![]() 肖女士
肖女士
![]() 021-33392297
021-33392297
![]() Kelly.Xiao@imsinoexpo.com
Kelly.Xiao@imsinoexpo.com
 2006-2025 上海博华国际展览有限公司版权所有(保留一切权利)
沪ICP备05034851号-57
2006-2025 上海博华国际展览有限公司版权所有(保留一切权利)
沪ICP备05034851号-57