今年4月份礼来宣布其IL-17单抗Taltz(ixekizumab)治疗放射学阴性中轴型脊柱关节炎(nr-axSpA)即强直性脊柱炎(AS)的三期临床试验COAST-X大获成功,并计划据在今年提交Taltz治疗nr-axSpA的监管申请文件。近日,Taltz再次传来喜讯:治疗r-axSpA的扩大适应症申请获得FDA批准。如果Taltz可以顺利获批用于治疗nr-axSpA,那么Taltz有望覆盖axSpA的整个疾病谱,进一步增强其市场竞争力。
中轴型脊柱关节炎(axSpA)是一种慢性炎症性疾病,主要影响骶髂关节和中轴骨,分为由骶髂关节的放射学结构损伤定义的患者亚组(放射学axSpA或强直性脊柱炎[AS])和无明显结构损伤的患者亚组(nr-axSpA)。估计全球450万成人受到影响。
Taltz是一种单克隆抗体,可以选择性地与白介素-17A(IL-17A)结合,抑制IL-17A与IL-17受体的结合,从而抑制促炎细胞因子和趋化因子的释放,进而缓解炎症性疾病的症状(IL-17A是一种天然存在的细胞因子,参与正常的炎症和免疫反应)。Taltz于2016年3月在美国首次获批,是继诺华Cosentyx(secukinumab)之后美国上市的第2款IL-17A单抗药物。目前,Taltz已经获批用于治疗活动性银屑病关节炎(PsA)成人患者和适合进行系统疗法或光疗的中度至重度斑块状银屑病成人患者。
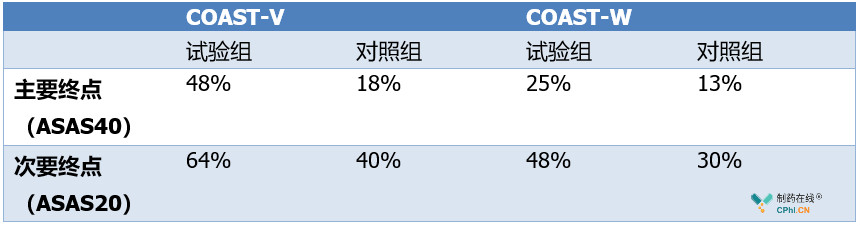
此次获批用于治疗AS主要基于基于2项名为COAST-V和COAST-W的3期临床试验,这两项临床试验分别旨在未接受过缓解病情抗风湿生物药(bDMARD)的AS患者中,以及对标准疗法肿瘤坏死因子抑制剂(TNFi)不起反应或不耐受的AS患者中,评估ixekizumab的有效性和安全性。COAST试验的主要终点和次要终点分别为,在16周时,达到达到脊柱关节炎国际协会评定40(ASAS40)的患者比例,以及ASAS20的患者比例,具体试验结果见下表:
已获批的IL-17单抗药物
截止目前,已经有三款IL-17单抗药物获批,分别是诺华的Cosentyx(secukinumab),礼来的Taltz(ixekizumab)和安进/阿斯利康的Siliq(Brodalumab)(详见下表)。
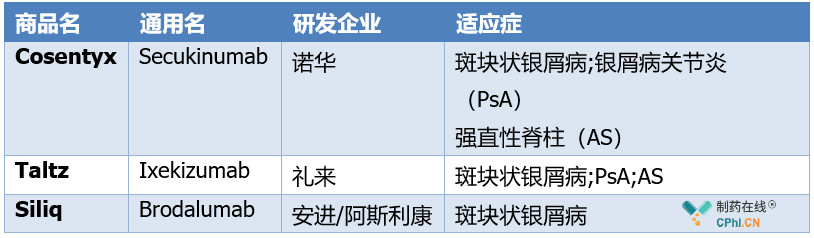
Cosentyx是一款全人源化的单克隆抗体,最早于2014年12月26日获日本PMDA批准,随后于2015年1月15日获欧洲EMA批准,同年1月21日获美国FDA批准,2016年1月和2018年2月分别扩增了适应症:治疗成人强直性脊柱炎和银屑病关节炎以及中度至重度头皮银屑病。2017年全球销售额高达21亿美元,2018年达28亿美元,IMS预测其销售峰值达到40亿美元。
Taltz是全球第二款IL-17A单抗抑制剂,于2016年3月22日获FDA批准,同年4月25日获得EMA批准,7月4日获日本PMDA批准,在此之前获批适应症有斑块状银屑病、银屑病性关节炎。2017年Taltz全球销售额为5.59亿美元,当前业界对Taltz的商业前景十分看好,医药市场调研机构Evaluate预测其2024年的销售额将达到27.07亿美元。
Brodalumab不同于市面上的其他IL-17信号通路抑制剂(如诺华Cosentyx和礼来Taltz,均靶向结合IL-17A),是首个也是唯一一个选择性靶向IL-17受体A(IL-17RA)的全人源化单克隆抗体。通过结合IL-17RA,brodalumab能够有效阻断多种促炎性IL-17细胞因子的生物学活性,抑制炎症信号通路。该药最初由安进研发,后安进因为临床数据显示Brodalumab与患者自杀倾向相关等原因,放弃了Brodalumab。
之后阿斯利康(AstraZeneca)和日本协和发酵麒麟株式会社(Kyowa Hakko Kirin)获得了该药的研发授权,2015年阿斯利康将此药授权于Valeant公司,2016年又授权给利奥制药。最终日本协和发酵麒麟株式会社负责该药日本地区的销售, Valeant负责在美国市场的销售,利奥制药负责在欧洲市场销售。Brodalumab于2016年7月04日获得日本PMDA批准上市,商品名为Lumicef®,2017年2月15日获美国FDA批准,商品名为Siliq,2017年7月17日获EMA批准,商品名为Kyntheum。
截止目前,Cosentyx和Taltz获批的适应症、获批范围相差不大,但Cosenty已率先在国内获批,用于治疗符合系统治疗获光疗指征的中度至重度斑块状银屑病成人患者,而brodalumab获批的适应症最少。给药方式上,Cosentyx和brodalumab均是皮下注射,而Taltz是静脉注射。用量剂量上,Cosentyx临床推荐剂量是300 mg,在0,1,2,3,和4周各给药一次,此后每四周一次。Taltz推荐剂量为第0周160mg (分两次注射,每次80mg),第2、4、6、8、10和12周各80mg,此后每周80mg,四周一次。Brodalumab的推荐剂量为每周一次,每次210mg,首次于第0、1、2周给药,此后每两周一次。
从当前的销售额来看,Cosentyx在当前获批的IL-17单抗中,占有明显的优势,然而随着对各自研究的深入,未来谁将统领IL-17单抗市场还不好说。并且还有多家IL-17单抗已经处于临床研究阶段,如艾伯维的ABT122、康方生物的AK101、恒瑞的SHR-1314等,尤其是恒瑞的SHR-1314,被业内人士评为"恒瑞潜力十大在研药物"之一。因此IL-17单抗领域如何发展,还需大家拭目以待。
参考资料:
[1] AstraZeneca agrees to buy US FDA Priority Review Voucher from Sobi. Retrieved Aug. 26, 2019
[2] 速递 | 礼来IL-17A拮抗剂3期结果积极,今年将递交监管申请. Retrieved Aug. 26, 2019



合作咨询
![]() 肖女士
肖女士
![]() 021-33392297
021-33392297
![]() Kelly.Xiao@imsinoexpo.com
Kelly.Xiao@imsinoexpo.com
 2006-2025 上海博华国际展览有限公司版权所有(保留一切权利)
沪ICP备05034851号-57
2006-2025 上海博华国际展览有限公司版权所有(保留一切权利)
沪ICP备05034851号-57