2019年8月,全球首次批准新药集中在美国。美国食品药品监督管理局(FDA)批准5个新分子实体药物(NME),分别为用于治疗腱鞘骨巨细胞瘤的Pexidartinib Hydrochloride;治疗肺结核的Pretomanid及获得性细菌性肺炎的Lefamulin acetate;治疗类风湿性关节炎的Upadacitinib;及治疗骨髓纤维化的Fedratinib。本月度,无最新生物制品获批。
表1. 2019年8月新分子实体(NME)及生物制品批准情况
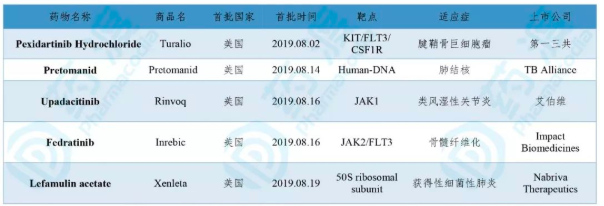
数据来源:药渡数据库
01、Pexidartinib Hydrochlorid
Pexidartinib由第一三共研发,于2019年8月2日获FDA批准上市,商品名为 Turalio® 。Turalio ®被批准用于治疗症状严重、功能限制且不适合手术改善的症状性腱鞘巨细胞瘤(TGCT)成人患者 [1] 。
腱鞘巨细胞瘤(TGCT)是指发生于手指和手部的坚实性无痛性肿块,肿块可侵袭邻近骨骼,足趾部少见,给患者带来严重的功能限制风险。本病通常以手术切除为主,术后可复发,但不转移。虽然外科手术目前仍是TGCT治疗的标准方式,但有些情况下手术也被认为临床无效,例如弥漫性的TGCT,其终身复发率高达55%。
Pexidartinib是一种小分子酪氨酸激酶抑制剂,靶向具有串联重复突变的KIT原癌基因受体酪氨酸激酶、FMS样酪氨酸激酶-3(FLT3)和集落刺激因子1受体(CSF1R)。CSF1R的过表达能促进滑膜细胞增殖和积聚。Pexidartinib能作为CSF1R的选择性抑制剂靶向作用CSF1/CSF1R信号通路,从而抑制肿瘤细胞增殖及下调参与疾病发生相关的细胞如巨噬细胞的生长。体内研究显示pexidartinib亦能抑制CSF1R依赖性细胞的增殖。它也能抑制CD117、KIT、FLT3和血小板衍生生长因子受体β,从而调节细胞的增殖与存活 [2] 。
表2. Pexidartinib共有靶点的临床及上市药物

数据来源:药渡数据库
02、Pretomanid
Pretomanid于2019年8月14日获美国食品药品监督管理局(FDA)批准上市,由TB Alliance在美国上市销售,适用于与贝达喹啉和利奈唑胺联合治疗广泛耐药(XDR)、治疗不耐受或无反应的多药耐药(MDR)的肺结核(TB)患者。该化合物最初由PathoGenesis(于2000年被Chiron收购)研发。2002年,Chiron(2005年被诺华收购)与TB Alliance签署共同研发该化合物的协议。TB Alliance将该药在中国的研发、注册、生产、销售权利授权给复星医药。该化合物于2016年4月28日由上海复星医药及其子公司上海星泰医药科技在中国提交临床申请,2016年11月获得临床试验批件[4]。
表3. Pretomanid同适应症的上市药物(2010年-2019年)
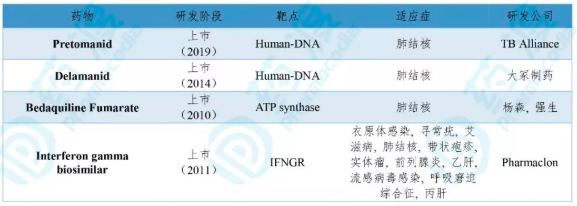
数据来源:药渡数据库
多重耐药结核病患者短程化学治疗是肺结核病治疗研究关注的热点。由于短程化学治疗疗程短、疗效好和服药方便等特点,在基础条件薄弱的地区也有条件开展。与其他治疗耐药性肺结核的传统制剂耗时较长不同的是,pretomanid给药量少,治疗时间短,效果更好。Pretomanid能杀死结核分枝杆菌并缩短耐药性肺结核患者的治疗时间。Pretomanid是一种前药,由硝基还原酶Ddn代谢激活,产生各种活性代谢物,通过诱导一氧化氮作用等方式产生治疗作用。Pretomanid通过抑制分枝菌酸的生物合成从而杀死复制中的结核分枝杆菌而发挥杀菌作用,但具体分子机制目前尚未明确[5]。
Pretomanid在美国成功获批主要基于BPaL方案(Pretomanid与贝达喹啉和利奈唑胺联合用药)的疗效在一项名为Nix-TB(Study 1,NCT02333799)的关键临床试验中的积极数据。Nix-TB是在南非进行的开放标签研究,针对广泛耐药(XDR)、治疗不耐受或无反应的多药耐药(MDR)的肺结核(TB)患者。共有109名广泛耐药以及对已有疗法不耐受或无反应的多重耐药的结核病患者参与试验。结果表明,接受治疗6个月后,BPaL方案的治疗成功率高达89%。根据文献综述,BPaL方案的治疗成功率大大超过了广泛耐药结核病的历史成功率 [6] 。
03、Upadacitinib
Upadacitinib由艾伯维研发,于2019年8月16日获美国食品药品监督管理局(FDA)批准上市,由艾伯维在美国上市销售,商品名为Rinvoq®。Rinvoq®是一种JAK1抑制剂,被批准用于治疗对甲氨蝶呤响应不足或不耐受的中重度类风湿性关节炎的成人患者。另外Upadacitinib治疗银屑病关节炎、克罗恩氏病、特应性皮炎、巨细胞动脉炎和溃疡性结肠炎正在进行临床三期研究,治疗强直性脊柱炎和系统性红斑狼疮正在进行临床二期研究,治疗幼年型类风湿性关节炎正在进行临床一期研究。2018年1月,Upadacitinib被美国FDA认证为治疗成人中度至重度异位性皮炎的突破性疗法。
Upadacitinib是一种JAK抑制剂。JAK是一种细胞内酶,通过细胞膜上的细胞因子或生长因子受体相互作用传递信号,影响造血的细胞内过程和免疫细胞功能。在信号通路中,JAK磷酸化并激活STATs来调节包括基因表达在内的细胞内活性。Upadacitinib通过调节JAK的信号通路,从而阻止STATs的磷酸化和活化 [8] 。
表4. Upadacitinib同靶点且同适应症的临床及上市药物
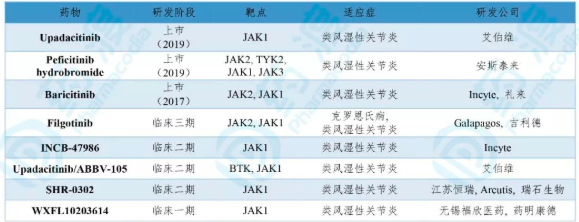
数据来源:药渡数据库
Rinvoq®在美国获批上市主要基于临床三期的SELECT研究项目。结果显示,Rinvoq®在SELECT临床试验中均达到了主要终点和关键性次要终点[8]。
主要终点:
SELECT-EARLY试验(Study RA-I,NCT02706873):未接受过MTX(甲氨蝶呤)治疗的患者,Rinvoq ® 15 mg治疗12周后实现ACR50(依据美国风湿病学会(American College of Rheumatology,ACR)的标准患者RA症状改善超过了50%)的患者比例为52%,接受MTX治疗的患者为28%。
SELECT-MONOTHERAPY试验(Study RA-II,NCT02706951):接受MTX治疗的患者改为接受Rinvoq ®治疗,14周之后实现ACR20的标准患者RA症状改善超过了20%,患者比例为68%,持续使用MTX治疗组为41%。
SELECT-NEXT试验(Study RA-III,NCT02675426):对cDMARDs(常规改善病情的抗风湿药)治疗响应不足的患者,Rinvoq®+cDMARDs在第12周实现ACR20的患者比例为64%,安慰剂+cDMARDs患者组为36%。
SELECT-COMPARE试验(Study RA-IV,NCT02629159):对MTX响应不足的患者,Rinvoq ®+MTX治疗组实现ACR20的患者比例为71%,安慰剂+MTX治疗的患者组为36%。
SELECT-BEYOND试验(Study RA-V,NCT02706847):对生物DMARDs(常规改善病情的抗风湿药)响应不足的患者,Rinvoq ® +cDMARDs在第12周实现ACR20的患者比例为65%,而安慰剂+cDMARD患者组为28%。
临床缓解:
SELECT-COMPARE试验中,Rinvoq ® 组和安慰剂组在12周时达到临床缓解(DAS28-CRP <2.6评估)为30% vs. 6%;SELECT-MONOTHERAPY试验中,Rinvoq ® 组和MTX组在14周达到临床缓解为30% vs. 8%;SELECT-EARLY试验中,Rinvoq ®组和MTX组在12周达到临床缓解为36% vs. 14%。此外,SELECT-COMPARE和SELECT-EARLY还进行了为期26周的持续临床缓解观察。SELECT-COMPARE试验的Rinvoq®组和安慰剂组为41% vs. 9%,而SELECT-EARLY的Rinvoq ® 组和MTX组为48% vs. 18%。
04、Fedratinib
Fedratinib于2019年8月16日获美国食品药品监督管理局(FDA)批准上市,由Impact Biomedicines在美国上市销售,商品名为Inrebic ® 。Fedratinib最初由TargeGen研发,2010年TargeGen被赛诺菲收购。但是由于临床试验中出现罕见的韦尼克脑病(Wernicke's encephalopathy,WE)并发症,FDA在2013年底叫停了fedratinib的临床研究,赛诺菲随即宣布暂停fedratinib的全部临床试验,放弃开发fedratinib。然而,该药的发明人John Hood博士成立Impact Biomedicines收购了fedratinib,并分析出现该副作用的原因可能与患者的维生素B1缺乏有关。后鉴于骨髓纤维化迫切的临床需要,FDA在2017年8月撤销了该药的临床暂停指令。2018年1月,新基公司收购了Impact Biomedicines [9] 。
Inrebic® 是一种JAK2和FLT3抑制剂,被批准用于治疗中高风险原发性骨髓纤维化和继发性骨髓纤维化(原发性血小板增多症后骨髓纤维化或真性红细胞增多症后骨髓纤维化)。JAK2在骨髓增生性肿瘤如骨髓纤维化中高度活跃。Fedratinib可高选择性地抑制 JAK2的信号转导和转录激活因子(STAT)3和5的磷酸化,从而阻止细胞分裂并诱导凋亡。在小鼠模型研究中,fedratinib能改善模型存活率,调节白细胞计数,红细胞压积等指标变化 [10] 。
表5. Fedratinib同靶点的临床及上市药物
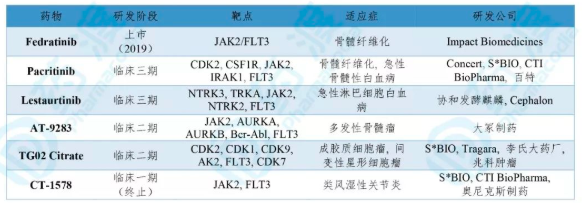
数据来源:药渡数据库
Inrebic®在美国获批上市主要基于一项多中心、随机、双盲、安慰剂对照临床三期试验(JAKARTA试验,NCT01437787)的积极结果。主要衡量疗效指标是6个周期后MRI或CT检测的患者脾 脏体积缩小>35%的患者比例。结果表明:37%接受Inrebic®治疗的患者脾 脏体积缩小>35%,安慰剂组为1%;40%的患者骨髓纤维化综合评分改善超过50%,安慰剂组为9%。上述两项结果显示,接受Inrebic®治疗的结果显著优于安慰剂组[10]。
05、Lefamulin acetate
Lefamulin acetate由Nabriva Therapeutics研发,于2019年8月19日获FDA批准上市,商品名为Xenleta ® 。Xenleta ® 是一种截短侧耳素抗菌药,用于治疗成人由易感微生物引起的社区获得性细菌性肺炎(CABP)。Xenleta®通过与细菌核糖体50S亚基的23s rRNA结构域V中的肽基转移酶中心(PTC)A位和P位的相互作用,抑制细菌蛋白质合成 [12] 。
表6. Lefamulin acetate同靶点且同适应症的临床及上市药物
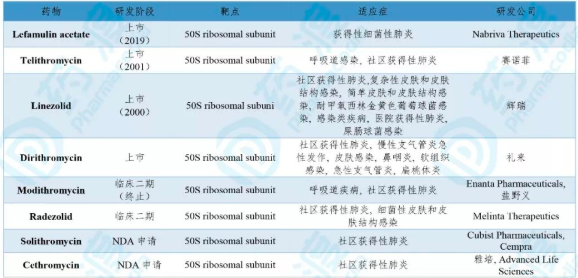
数据来源:药渡数据库
Xenleta®在美国获批主要基于2项关键性三期临床研究LEAP-1(NCT02559310)和LEAP-2(NCT02813694)的积极数据结果。这2项研究共涉及1289名CABP成人,评估了静脉注射制剂和口服制剂Xenleta®相对于莫西沙星(moxifloxacin)治疗CABP成人患者的疗效和安全性。主要终点为在意向治疗(ITT)患者群体中早期临床反应(ECR),被定义为在研究药物开始72~120小时的疗效。在LEAP-1研究中,Xenleta®疗效与莫西沙星(有或无利奈唑胺)相比达到非劣效性。在有意向治疗(ITT)人群中,使用Xenleta®的患者的早期临床反应(ECR)率为87.3%,使用莫西沙星或莫西沙星与利奈唑胺的ECR率为90.2%,治疗差异为-2.9 [95%CI:-8.5, 2.8]。在LEAP-2研究中,Xenleta®虽然治疗时间较莫西沙星少2天但疗效相当。在以上2项研究中,Xenleta®均被证明非劣效于莫西沙星[12]。
参考资料
1.药渡数据:https://data.pharmacodia.com/web/basic/basic_detail_PN1245.html (accessed August 2019).
2. Drug Bank database:https://www.drugbank.ca/drugs/DB12978 (accessed August 2019).
3. FDA Database: https://www.accessdata.fda.gov/drugsatfda_docs/label/2019/211810s000lbl. pdf (accessed August 2019).
4. 药渡数据:https://data.pharmacodia.com/web/basic/basic_detail_PN1573. html (accessed August 2019).
5. Drug Bank database:https://www.drugbank.ca/drugs/DB05154 (accessed August 2019).
6. FDA Database:https://www.accessdata.fda.gov/drugsatfda_docs/label/2019/212862s000lbl. pdf (accessed August 2019).
7. 药渡数据:https://data.pharmacodia.com/web/basic/basic_detail_PN1203. html (accessed August 2019).
8. FDA Database: https://www.accessdata.fda.gov/drugsatfda_docs/label/2019/211675s000lbl. pdf (accessed August 2019).
9. 药渡数据:https://data.pharmacodia.com/web/basic/basic_detail_PN2090. html (accessed August 2019).
10. FDA Database: https://www.accessdata.fda.gov/drugsatfda_docs/label/2019/212327s000lbl. pdf (accessed August 2019).
11. 药渡数据:https://data.pharmacodia.com/web/basic/basic_detail_PN1059. html (accessed August 2019).
12. FDA Database: https://www.accessdata.fda.gov/drugsatfda_docs/label/2019/211672s000,211673s000lbl. pdf (accessed August 2019)



合作咨询
![]() 肖女士
肖女士
![]() 021-33392297
021-33392297
![]() Kelly.Xiao@imsinoexpo.com
Kelly.Xiao@imsinoexpo.com
 2006-2025 上海博华国际展览有限公司版权所有(保留一切权利)
沪ICP备05034851号-57
2006-2025 上海博华国际展览有限公司版权所有(保留一切权利)
沪ICP备05034851号-57