2019年Q3,中国药企获得FDA批准的ANDA再添24个,同比上升9.1%,共计22个活性成分,来自16家中国药企。2019年前三季度中国药企获批的ANDA总计达到69个,同比上升18.97%。
表1:2019年Q3中国药企获FDA批准的ANDA
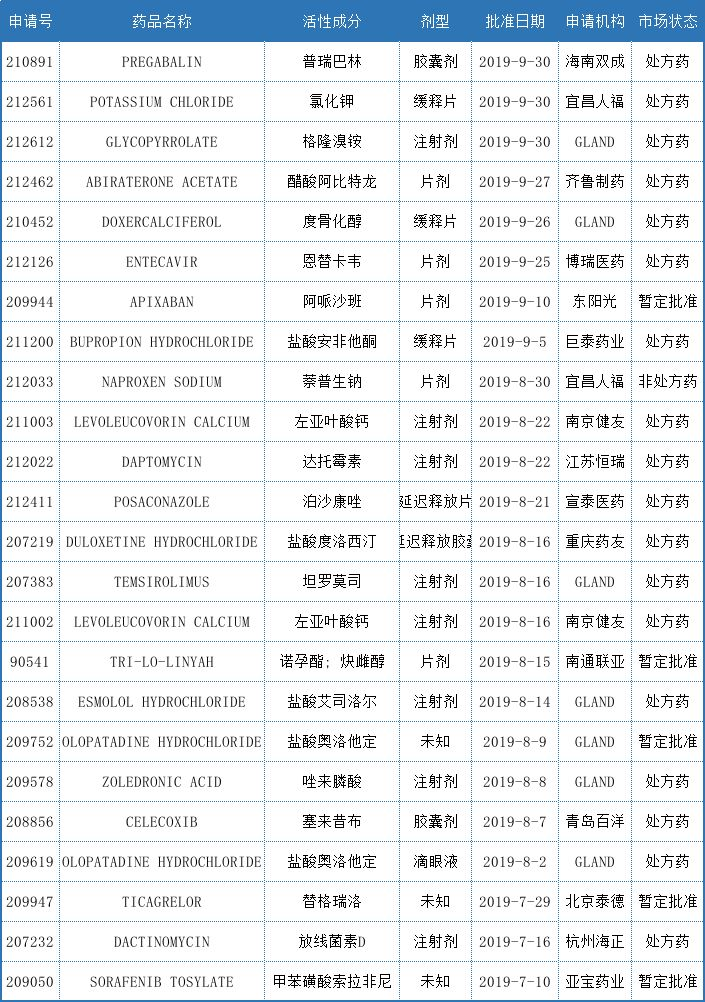
2019年Q3批准的产品中,暂定批准的ANDA共5个,占比20.83%。FDA的暂定批准意味着:由于专利权和/或独占权(exclusivity)的原因无法在美国上市,但它符合用于在美国上市的FDA质量、安全和有效性标准。
宜昌人福的萘普生钠片是唯一一个非处方药,该药为镇痛类药物,用于暂时缓解轻微的疼痛,包括关节炎轻微疼痛、肌肉酸痛、背痛、月经抽筋、头痛、牙痛、普通感冒及暂时退热等。宜昌人福于2018年提交萘普生钠片的ANDA申请,累计研发投入约为人民币800万元。根据IQVIA数据统计,2018年5月31日~2019年5月31日,萘普生钠片在美国市场的销售额约为4400万美元,主要生产厂商包括Bayer、MajorPharm等。
图1:2019年Q3中国药企ANDA市场状态分类
2019年Q3,中国药企的国际化道路中又添三个新面孔——北京泰德、浙江巨泰(普洛药业全资子公司)、博瑞医药。截止目前,已经有39个中国药企(部分含有多个子公司)获得了美国FDA批准的ANDA。
7月29日,北京泰德的替格瑞洛片获得FDA的暂定批准,主要适用于急性冠状动脉综合征的治疗。据统计,替格瑞洛片2017年全球销售额约12.5亿美元,其中美国市场销售额约6.9亿美元;2018年1~9月全球销售额约11.8亿美元,其中美国市场销售额约6.7亿美元。同时,海正、华海、东阳光的替格瑞洛片也获得了FDA批准。
9月5日,普洛药业全资子公司浙江巨泰药业有限公司的盐酸安非他酮缓释片获FDA批准,用于治疗中重度抑郁症以及季节性情感障碍。该药物由VALEANT研发,于2003年8月28日在美国上市。巨泰药业在盐酸安非他酮缓释片项目上累计已投入研发费用约150万美元。
9月25日,博瑞医药的恩替卡韦片获得FDA的暂定批准,该药物是美国、欧洲、亚太和WHO等所有《慢性乙型肝炎防治指南》一致推荐的抗乙肝病毒一线药物。据NEWPORT数据显示,2018年3月-2019年3月,恩替卡韦口服制剂全球销售额为14.33亿美元,其中美国销售额为6200万美元。
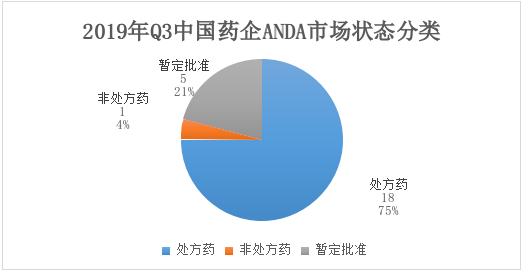
2019年Q3获批ANDA最多的中国企业是复星医药,达到8个,其中7个来源于收购公司GLAND,1个来源于子公司重庆药友。其次为南京健友和人福医药,均获批2个,海正药业的ANDA分别来源于旗下的杭州海正。
表2:2019年Q3各中国药企获FDA批准的ANDA数量
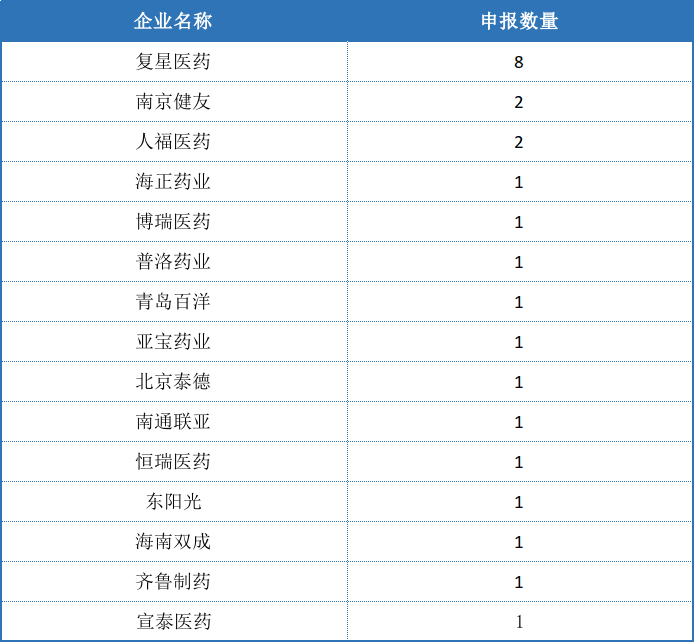
最后再看看中国药企近10年获FDA批准的ANDA,包括购买的和收购公司后的数据,如复星医药收购GLAND后,GLAND的ANDA算在复星医药里。可能有读者觉得不对,2018年批准的数量不是达到100了吗?是因为有些暂定批准转正后不再纳入当年的统计范围。
图2:中国药企近10年获FDA批准的ANDA



合作咨询
![]() 肖女士
肖女士
![]() 021-33392297
021-33392297
![]() Kelly.Xiao@imsinoexpo.com
Kelly.Xiao@imsinoexpo.com
 2006-2025 上海博华国际展览有限公司版权所有(保留一切权利)
沪ICP备05034851号-57
2006-2025 上海博华国际展览有限公司版权所有(保留一切权利)
沪ICP备05034851号-57