国内新药临床申请、临床试验呈现逐年攀升的趋势,这将导致临床不良风险事件(SAE)发生的可能性增加,在这种情况下,无论申办方还是受试者,都需要通过有效的第三方保险来降低自身风险。我国药物临床试验保险发展才起步,存在政策不完善、行业非标化、保险公司不专业以及申办方或受试者投保意识低等问题。探索临床试验保险的改进方向,为临床试验参与双方保驾护航是我国目前临床试验保险行业需要努力的方向。
一、药物临床试验保险概述
临床试验保险是在临床试验过程中,申办方为受试者、研究者和/或机构、伦理委员会购买的保险。目前,市场上比较普遍的保险为临床试验责任险,另有些非专业性的临床试验保险,即通用险种,如如公众责任险、产品责任险、无过失补偿、商业一般保险等。
临床试验责任险主要是指保险公司承保的经过批准的药物临床试验,在临床试验过程中出现了因试验药物发生的不良反应或严重不良反应,造成受试者人身伤亡,依《知情同意书》约定,应由被保险人负损害补偿责任,且在保险期间内提出补偿请求时,由保险公司在保险金额范围内对被保险人负赔偿责任的保险。
临床试验保险包括:(1)保险投保流程;(2)报案流程。当受试者在临床实验过程中出现不良事件(SAE),首先由研究者对该不良进行判断与试验药物的相关性,当确定可能或一定相关时,受试者就可申请保险公司索赔相关损失,这个过程称之为报案。
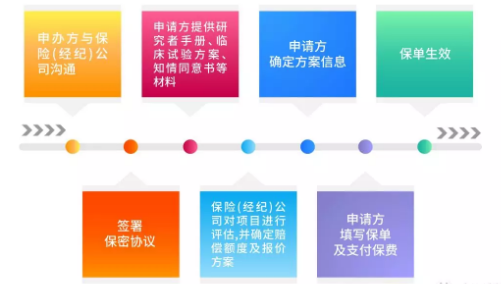
图1 投保流程
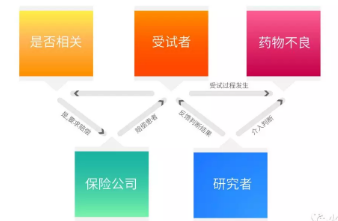
图2 报案流程
二、我国加快药物临床试验保险发展的重要性
1. 临床试验伴随高风险,需要为受试者进行安全保障。
临床试验过程中存在风险的主要原因是,药物临床试验本身就是药物安全性和有效性的验证试验,试验方案设计、试验药物、试验过程的质量等可能对受试者造成一定程度的损害。
另外,研究者时间、精力,标准操作规程和知情同意等过程,存在受试者隐瞒病情、依从性等潜在问题和风险。由于存在个体差异,即使对一部分受试者是安全的,对另一部分受试者可能产生一定程度的损伤。因此,临床试验过程中存在风险可谓无处不在。
我国临床试验期间死亡的病例不少,但在临床试验过程中,客观缺乏对受试者相应的保障措施,有关临床试验相关安全性问题的诉讼案件也在增多。比较典型的案例是“韩国人参丸事件”、“拜耳索赔事件”和“TGN 1412 I期临床试验”。
2. 我国创新药进入加速期,加上MAH制度的实施,国内新药临床试验数增加,发生临床不良风险事件的可能性增加。
上市许可与生产许可分离模式,从源头上减少制药企业的低水平重复建设,提高新药研发积极性,促进委托生产的繁荣,从而推进我国医药产业的快速发展。可以预见,近几年将会出现大量的创新药进入临时申请和临床试验的阶段。
伴随临床试验的增加,发生临床试验风险事件的可能性增加。在这种情况下,无论申办方还是受试者,都需要通过有效的第三方保险来降低自身风险。
二、国内外临床试验保险对比分析
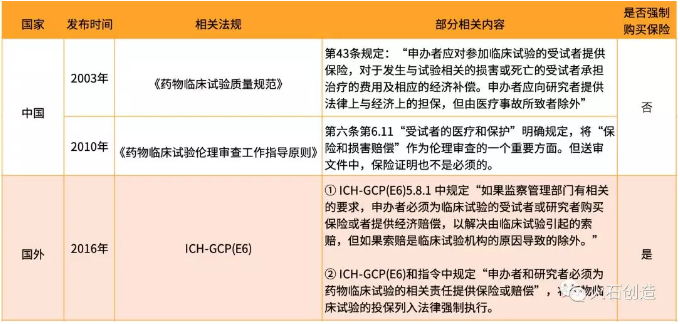
1. 国内外相关法规比较
国外强制要求申办方为参加临床试验的受试者或研究者及相关人员提供保险,而我国目前没有强制要求。另外,我国虽将“保险和损害赔偿”作为伦理审查的一个重要方面,但送审文件中保险证明也不是必须的。
表1 国内外有关药物临床试验保险的法规比较
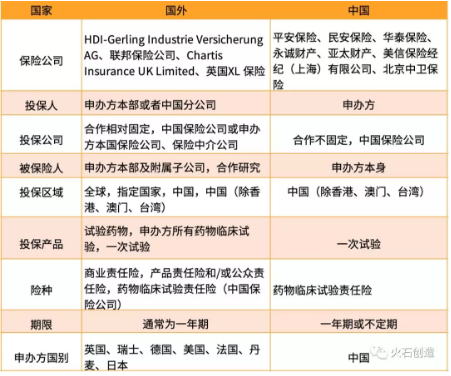
2. 保险公司及投保差异
国外从事临床试验保险行业的保险公司专业性强、规模较大,国内保险公司进入这个新兴行业较晚,规模相对较小,虽然开展了临床试验保险业务,但从产品结构、定价策略、投保方式、专业评估等方面与国外保险公司存在一定差距。
表2 国内的保险公司及投保差异比较
3. 国内外申办方投保情况
从临床试验风险上,I期作为初步的临床药理学和人体安全性评价试验,是试验药物在人体的首次使用,风险相对较大。III期临床试验是药物疗效的确证阶段,是药物上市之前的大规模的临床试验,需要大样本量的受试者来验证药物的安全性和有效性,探索 I、II 期临床试验中不易发现的、少见的不良反应,同时,需要通过大量的人群确证药物在相应病种和人群中是有效的。较多的受试者也就意味着较多的不良事件和严重不良事件的出现。
目前国内的申办方普遍缺乏针对临床试验投保的意识,不仅让受试者处于弱势地位,无法保障其权益,也将自身立于高风险境地。反观国外申办者,由于身处高诉讼的环境中,法律意识强,其投保行为也远远高于国内申办方。
四、我国临床试验保险行业发展过程中问题及痛点
(一)综合原因导致的临床试验保险覆盖率低
1. 缺乏强制性政策法规
由于国内法规未强制临床试验投保,同时伦理委员会对受试者的权益保护也不够完善,直接导致我国的临床试验保险覆盖率低。
2. 国内不良事件赔付成本低,申办者投保和风险分担意识不强。
临床试验保险是申办方转移新药风险,减少支付医疗费用和相关赔偿损失的有效途径。目前很多不良事件是通过私下沟通解决,不会出现大量的资金赔付,而国外一旦出现不良,企业需要承担巨额赔款甚至是破产,所以国外企业有很强的风险分担意识。
3. 缺乏专业性保险公司,临床试验保险业务刚起步。
临床试验保险属新兴行业,国内专业性保险公司较少。很多投保按“一事一议”方式进行,无法衡量临床试验过程中的损害和赔偿,因此不敢贸然从事该行业,导致没有足够的产品投放向市场。
(二)保险品种不规范
为临床试验项目投保的保险险种多样,其中临床试验责任保险是目前最多的险种,也是专门针对临床试验的险种,它明确各方在临床试验中的职责,在购买保险时已经明确规定由于申办方、研究者或机构、伦理委员会的责任造成的患者的损失时,保险公司会对其进行赔偿。
有很多申办方在临床试验中为自己的产品购买产品责任险或公众责任险,将临床试验保险涵盖在公众责任险、产品责任险、无过失补偿保险中,在赔偿过程中可能会存在赔偿范围不明确等问题而影响对受试者的赔付,损害受试者的权益,因此,保险公司应当对临床试验保险有规范的保险险种。
(三)缺乏判断评价SAE的标准和专业机构
我国在临床试验保险领域起步晚,对不良事件与药物关系的判定还缺乏专业权威机构和合理的判定标准。研究者判断是临床试验 SAE 与药物的相关性的关键,更是保险公司赔付的依据。
由于我国的临床试验保险发展不完善,认定不良事件不能完全按照国外的标准,有些情况下,理赔过程不可能完全按照国外 SAE 的认定流程的要求,可能会给国内受试者索赔造成一定的阻碍。
五、小结
综上所述,借鉴国外优秀经验,并结合我国实际情况,首先应完善GCP 等相关政策法规,明确临床试验保险责任、范围和监督实施,尤其针对创新药物临床试验(一期和三期的风险较大)和高风险临床试验项目的保险。
同时,应让申办方认识到,购买保险不仅是为自身避免潜在的重大风险,也是对药物研究者人员、受试人员及其家属的重要承诺。保险公司更应多借鉴国外丰富的经验,如产品种类方案、SAE赔付流程等,提升自身专业性。
另外,非常关键的是要提高国内SAE的判别准确度,为专家提供有效的数据支撑。亟待建立一个标准的、统一的数据库承载国内外的经典案例和判定依据,并利用专家经验+大数据+AI技术输出合理的判断标准。一方面,不仅能提升判定SAE的精准度;另一方面,有助于提升国内临床试验保险行业专业度。
如需转载,请联系火石创造沟通授权事宜。



合作咨询
![]() 肖女士
肖女士
![]() 021-33392297
021-33392297
![]() Kelly.Xiao@imsinoexpo.com
Kelly.Xiao@imsinoexpo.com
 2006-2025 上海博华国际展览有限公司版权所有(保留一切权利)
沪ICP备05034851号-57
2006-2025 上海博华国际展览有限公司版权所有(保留一切权利)
沪ICP备05034851号-57