2019年11月20日,诺华发布消息称,近日,诺华肿瘤(中国)旗下产品达希纳®(尼洛替尼)新适应症获得中国国家药品监督管理局(NMPA)批准,用于治疗2岁以上儿童慢性髓性白血病。
这是继2009年尼洛替尼获批用于治疗既往治疗(包括伊马替尼)耐药或不耐受的费城染色体阳性的慢性髓性白血病(Ph+CML)慢性期或加速期成人患者和2016年获批用于治疗新诊断的费城染色体阳性的慢性髓性白血病(Ph+CML)慢性期成人患者后,在中国获批的又一适应症。
新适应症的获批也使尼洛替尼成为国内二代酪氨酸激酶抑制剂(TKI)药物中唯一用于治疗儿童慢性髓性白血病的药物。
实际上,在慢性髓性细胞白血病(CML)治疗领域中,BCR-ABL酪氨酸激酶抑制剂(TKI)药物已从第一代伊马替尼(商品名“格列卫”)进入到第二代尼洛替尼(达希纳)、达沙替尼(施达赛)以及新型二代氟马替尼,并正向第三代迈进,例如亚盛医药HQP1351。
第一代TKI:CML靶向治疗始于伊马替尼
伊马替尼作为正式针对BCR-ABL靶点的首个上市药物,拉开了肿瘤TKI靶向治疗的序幕。据了解,伊马替尼由诺华研发,于2001年5月获美国食品药品管理局(FDA)批准上市,2001年11月获欧洲药物管理局(EMA)批准上市,后于2002年进入中国,成为慢粒白血病的一线用药,商品名“格列卫”,在电影《我不是药神》上映后引发了市场高度关注。
目前,伊马替尼已经过了专利保护期,仿制药也自2013开始不断获批——豪森药业“国产格列卫”(商品名“昕维”)2013年获批,并在2018年成为该药品首家通过一致性评价的企业;正大天晴“格尼可”于2013年获批,2019年通过一致性评价;石药集团欧意药业“诺利宁”则于2014年获批。
从市场占比看,“格列卫”份额占到80%以上,随后是豪森药业的“昕维”约为12%,正大天晴的“格尼可”约为3%,石药欧意的“诺利宁”占比较小,不足1%。
除上述四家分割者外,药友制药、齐鲁制药、信立泰等众多药企纷纷加入“国产格列卫”的竞争格局中,不容小觑。
第二代TKI:诺华、BMS争雄,豪森“有戏”
伊马替尼令慢性髓性细胞白血病(CML)成为一种可控的慢性疾病,但其仍有改进的空间,随着百时美施贵宝达沙替尼、诺华尼洛替尼的推出,第二代酪氨酸激酶抑制剂在CML的一线和二线治疗中逐渐占据了重要地位。
作为伊马替尼的同门,尼洛替尼被称作是“格列卫”的更新产品。体外研究显示,尼洛替尼能够选择性抑制bcr-aLl自磷酸化,降低野生型bcr-aLl和“格列卫”耐药突变细胞的增殖和发育能力。2018年,诺华肿瘤药业务收入为118.11亿美元,尼洛替尼(达希纳)、伊马替尼(格列卫)年度销售均超过10亿美元,影响力可见一斑。
截至目前,尼洛替尼在中国已经获批三个适应症:用于治疗既往治疗(包括伊马替尼)耐药或不耐受的费城染色体阳性的慢性髓性白血病(Ph+CML)慢性期或加速期成人患者、费城染色体阳性的慢性髓性白血病(Ph+CML)慢性期成人患者、2岁以上儿童慢性髓性白血病。
达沙替尼则是由百时美施贵宝研发,2006年获美国食品药品管理局(FDA)批准用于治疗对包括甲磺酸伊马替尼在内的治疗方案耐药或不能耐受的慢性髓细胞样白血病(CML)所有病期(慢性期、加速期、淋巴细胞急变期和髓细胞急变期)的成年患者,后续又获得多个新的适应症批准,迄今已经在40余个国家获批上市,并于2011年在中国获批,商品名“施达赛”。
值得一提的是,达沙替尼在我国已经首仿上市(2013年9月正大天晴成功拿下首仿),并且价格远低于原研药。实际上,达沙替尼的仿制大战并不逊色于伊马替尼,双鹭药业、石药欧意、齐鲁制药、国药一心等更是觊觎已久。
此外,豪森药业历时超过十年研发的氟马替尼更是以新型二代Bcr-AblTKI抑制剂,被认为是升级版的“格列卫”,从其药品分子结构上看,氟马替尼是在诺华尼洛替尼分子结构上的优化产生。
2006年9月,豪森药业首次提交化药1.1临床试验申请,2007年8月批准临床。2008年获国家科技重大专项支持,2012年获江苏省科技成果转化专项支持,2018年9月以具有明显治疗优势创新药为由被纳入优先审评程序。2019年11月,由豪森药业自主研发的抗肿瘤1类新药氟马替尼(受理号:CXHS1800017)在国内的上市申请审批状态变更为「在审批」,经过一轮补充资料、临床试验现场核查和生产现场核查,预测该药将很快获批上市。
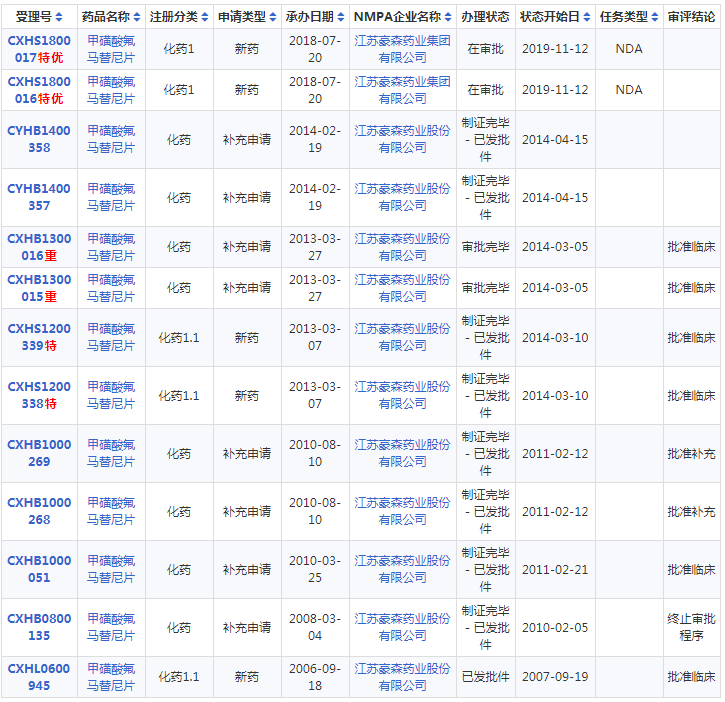
图1氟马替尼研发审批历程,来源:药智网数据
据了解,氟马替尼明显抑制细胞内BCR-ABL酪氨酸激酶的活性,作用强于伊马替尼;对 BCR-ABL的下游信号如extracellualar-regulated kinase (ERK))以及血小板衍生生长因子受体 (PDGFR)也有抑制作用。
2019年美国临床肿瘤学会(ASCO)上,中国医学科学院血液学研究所张丽教授展示了氟马替尼慢性髓系白血病治疗的III期临床研究结果。结果显示,对于我国初诊慢性髓系白血病慢性期患者,氟马替尼与伊马替尼的安全性相当,但氟马替尼在3个月、6个月和12个月的疗效均优于伊马替尼。
作为自主研发的第二代新型Bcr-AblTKI抑制剂,氟马替尼获批后,将与豪森药业“4+7”集采品种伊马替尼(商品名“昕维”)协同占领抢占慢性粒细胞白血病市场,扩大市场优势地位。
第三代TKI:耐药性抢眼,明年有望递交NDA
“江山代有人才出,一代新人胜旧人”。TKI药物虽然开创了慢粒白血病靶向治疗时代,为慢粒白血病的治疗带来了巨大的改观,但耐药性的出现促使生物医药企业不得不进一步开发更为新型的TKI药物。
以亚盛医药基于BCR-ABL突变体的新一代激酶抑制剂HQP1351为例,作为口服第三代酪氨酸激酶抑制剂(TKI)药物,靶向多种突变,包括具有T315I突变的类型,初步的临床数据显示,该产品可以有效克服一代、二代BCR-ABL TKI耐药,尤其是对T315I突变的慢性髓性白血病(CML)患者有显著疗效。
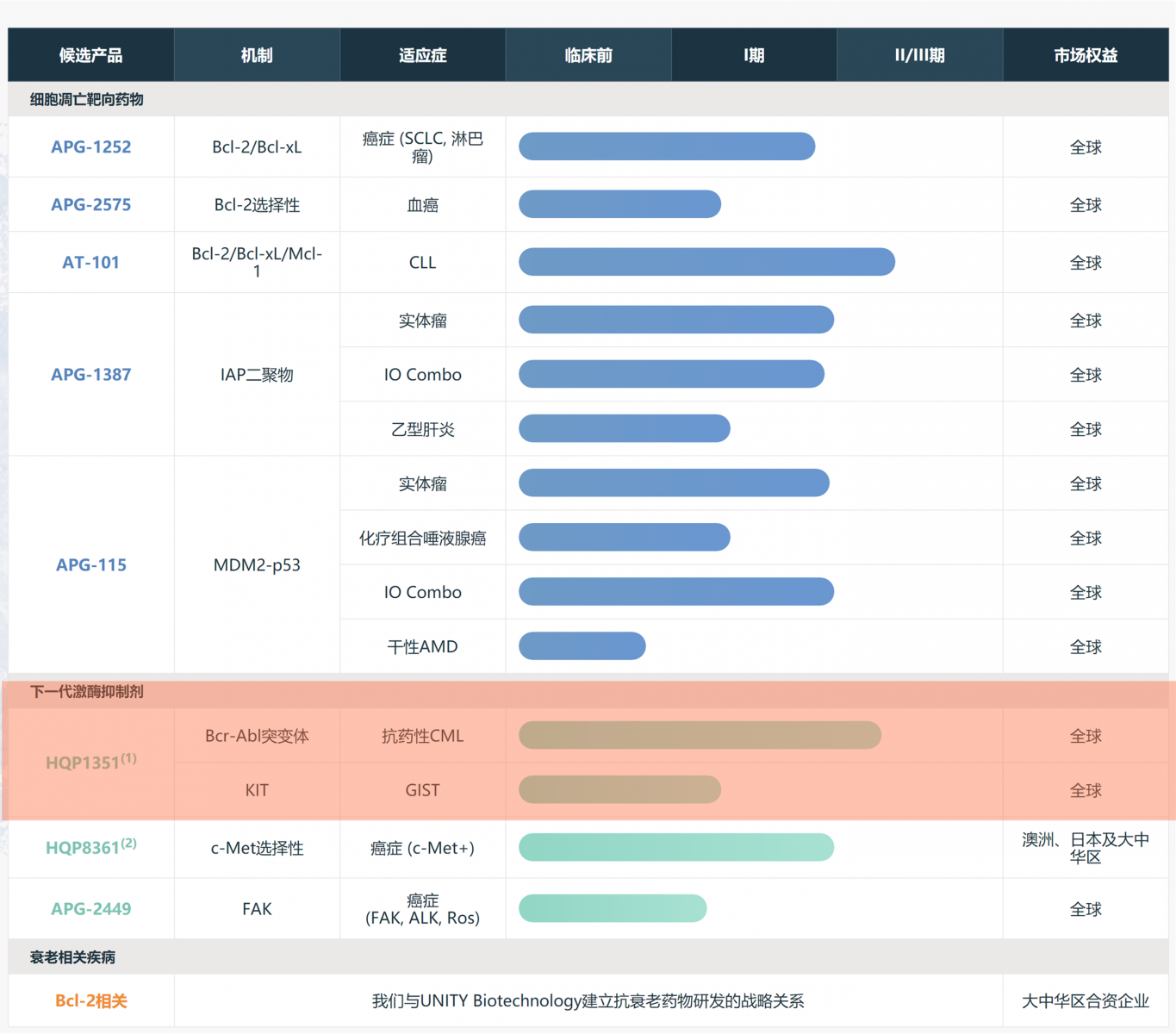
图2亚盛医药临床产品组合,来源:企业官网
亚盛医药今年11月在第61届美国血液学会(ASH)年会上公布了针对TKI耐药的第三代BCR-ABL抑制剂HQP1351临床安全性与初步疗效的I期结果的更新数据,截至2019年5月27日,该研究共纳入101例患者。研究数据显示,HQP1351在TKI耐药的CML患者(包括携带T315I突变的患者)中具有良好的耐受性,并表现出显著且持久的抗肿瘤活性。
新浪医药获悉,HQP1351的关键II期临床试验正在进行中,亚盛医药计划于2020年年中在中国递交NDA。今年7月,FDA也批准了该药物可以在美国进行治疗T315I突变或TKI抗药性CML患者Ib期临床试验的IND。
根据Frost&Sullivan资料显示,2018年在中国的慢性髓性白血病(CML)药物销售额达46亿元,到2023年市场规模将预计增长至142亿元。
该领域内,会不会出现国内药企问鼎的局面?就目前的市场格局和产品开发进展而言,尚没有企业具有与诺华、百时美施贵宝等争雄的实力,但豪森药业的第二代新型Bcr-Abl TKI抑制剂以及亚盛药业的第三代已经具备了相应的市场潜力。随着价格、竞争因素的影响,跨国药企CML药物市场份额将会持续走低,本土药企的机会就在这里!



合作咨询
![]() 肖女士
肖女士
![]() 021-33392297
021-33392297
![]() Kelly.Xiao@imsinoexpo.com
Kelly.Xiao@imsinoexpo.com
 2006-2025 上海博华国际展览有限公司版权所有(保留一切权利)
沪ICP备05034851号-57
2006-2025 上海博华国际展览有限公司版权所有(保留一切权利)
沪ICP备05034851号-57