21日,恒瑞集团发布公告《关于获得临床试验通知书的公告》,称公司注射用SHR-1802近日收到国家药品监督管理局(以下简称“国家药监局”)核准签发的《临床试验通知书》,同意批准本品开展临床试验。该药品为我公司自主研发和生产的人源化单克隆抗体,可激活和促进抗肿瘤T细胞应答,发挥抗肿瘤作用,用于标准治疗失败的晚期恶性肿瘤。
其次在公告中提示了一条重要信息:经查询,国内外现无同类产品上市销售,亦无销售数据。国外有MGD-013、relatlimab等产品处于临床试验阶段,国内有IBI-110、LBL-007等产品处于临床试验阶段。
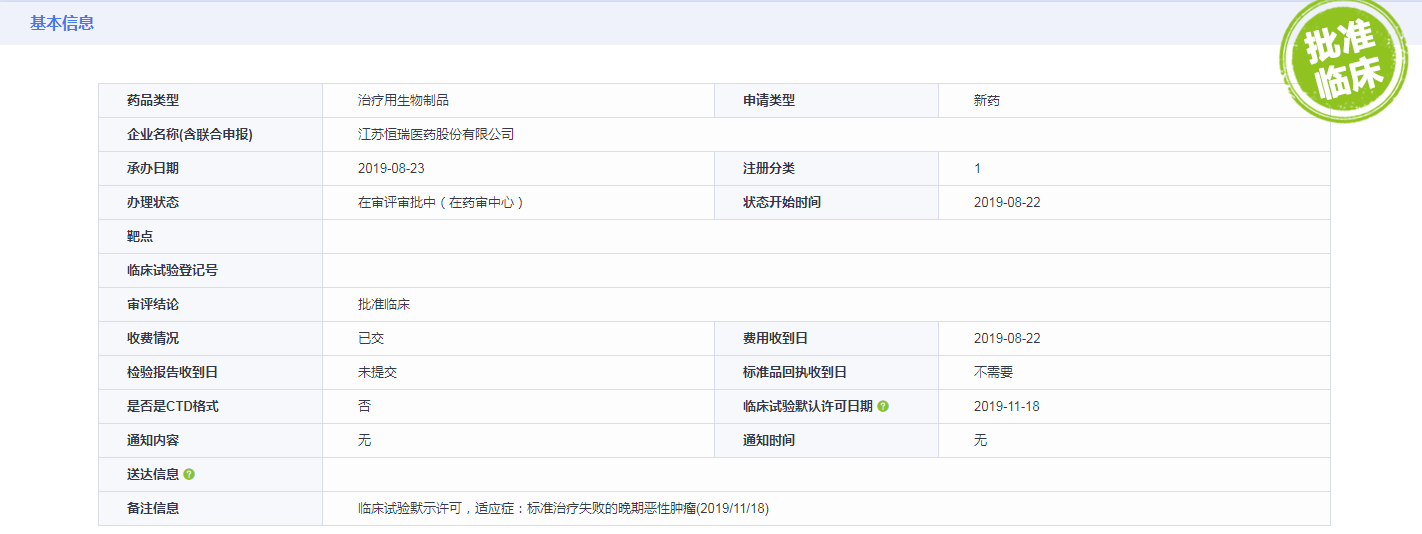
截至目前,该产品项目已投入研发费用约为1,666万元人民币。
网友A:“一种药物从临床1期到研发结束的平均开发时间在过去10年里增加了26%,2018年增加了6个月,达到12.5年。2018年,从临床1期试验到监管提交阶段的综合成功率(根据药物成功进展到下一阶段开发的百分比)下降到11.4%。”福布斯杂志也指出,美国药企研发的新药,有95%以失败告终,无法上市。
网友B:以研发难度较高的阿尔茨海默病为例,新药研发难度高的吓人,不少知名药企都折戟沉沙,进入临床并不一定意味着成功,反而正是苦难的开始!
2018年1月,武田制药宣布吡格列酮的阿尔茨海默病Ⅲ期临床试验失败;辉瑞宣布放弃阿尔茨海默病领域的阿药物研发;丹麦制药公司Lundbeck的idalopirdine试验性药物未能阻止轻度及中度阿兹海默症患者的认知能力下降,它曾被看作是治疗阿兹海默症最有希望的药物之一;
2018年2月,默沙东宣布停止Verubecestat的临床试验;
2018年6月,礼来与阿斯利康联合开发的lanabecestatⅢ期临床中止;
2019年1月,罗氏宣布CrenezumabⅢ期临床失败……
网友C:虽说,新药成功率的确不到10%,但为何还是有那么企业挤破头的往里面钻,就是因为一旦成功,回报率一千倍不止!我相信恒瑞,研发实力我看好!
(以上言论均来自于网友自主评论,药智网转述)
可见,新药研发前景可期的确是大众一致认识,但其研发风险也的确是存在,而在此次恒瑞公告,大部分其实都表示都其比较看好,或许这源自于恒瑞一直以来再人民心中营造的“中国药物研发第一企业”的形象,也来源于人们对恒瑞研发实力的信任。



合作咨询
![]() 肖女士
肖女士
![]() 021-33392297
021-33392297
![]() Kelly.Xiao@imsinoexpo.com
Kelly.Xiao@imsinoexpo.com
 2006-2025 上海博华国际展览有限公司版权所有(保留一切权利)
沪ICP备05034851号-57
2006-2025 上海博华国际展览有限公司版权所有(保留一切权利)
沪ICP备05034851号-57