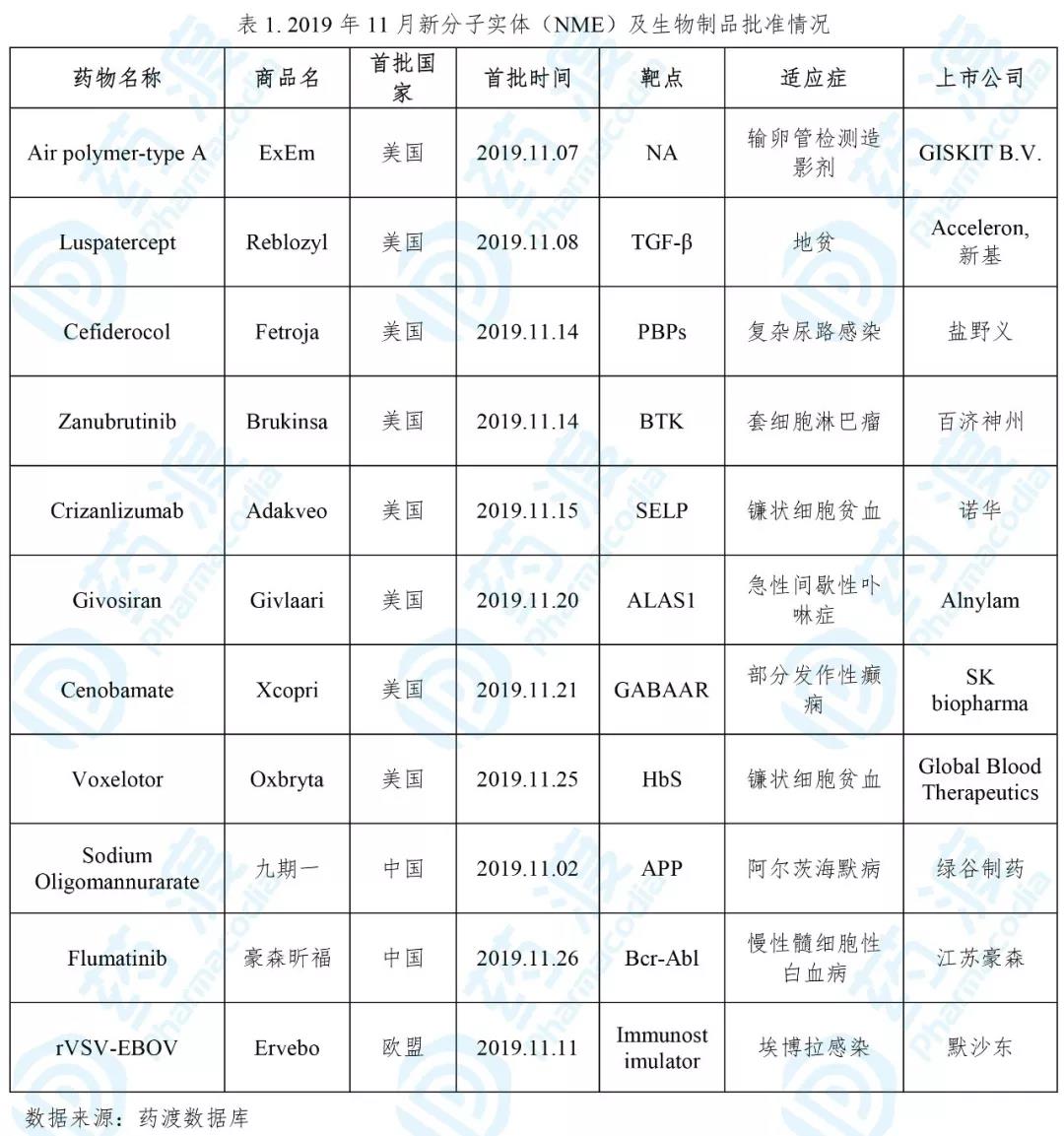
11月,全球首次批准新药主要集中在美国、中国和欧盟。美国食品药品监督管理局(FDA)批准6个新分子实体药物(NME),用于输卵管通畅性检测的造影剂Air polymer-type A,用于治疗复杂尿路感染的Cefiderocol,用于治疗套细胞淋巴瘤的Zanubrutinib,用于治疗急性间歇性卟啉症的Givosiran,用于治疗部分发作性癫痫的Cenobamate,用于治疗镰状细胞贫血的Voxelotor。国家药品监督管理局(NMPA)批准NME药物2个,分别为治疗阿尔茨海默病的Sodium Oligomannurarate,治疗慢性髓细胞性白血病的Flumatinib。此外,FDA批准新生物制品2个,分别为治疗地贫的Luspatercept,治疗镰状细胞贫血的Crizanlizumab。欧洲药物管理局(EMA)批准新**1个,用于预防埃博拉病毒感染的rVSV-EBOV。
01
Air polymer-type A
Airpolymer-type A已经于2019年11月7日获得FDA批准,用于超声子宫输卵管造影以评估已知或怀疑不孕的妇女输卵管通畅性。该药由GISKIT B.V.研发,商品名为ExEm® [1]。
夫妻不孕病例中,约12~33%是由输卵管阻塞导致。因此,评估输卵管通畅性是检测不育的常规项[2,3]。
ExEm®由羟乙基纤维素组成,是一种回声造影剂。当利用超声进行可视化时,泡沫将在输卵管和腹膜腔内显示回声或明亮信号[4]。
ExEm®的获批是基于两项子宫输卵管超声泡沫造影(HyFoSy)研究。试验A中,2D成像能够评估出80%的输卵管阻塞和92%的输卵管通畅,3D成像测试分别达到98%和91%。试验B联合2D/3D成像技术,检测结果与试验A相似[4]。
02
Luspatercept
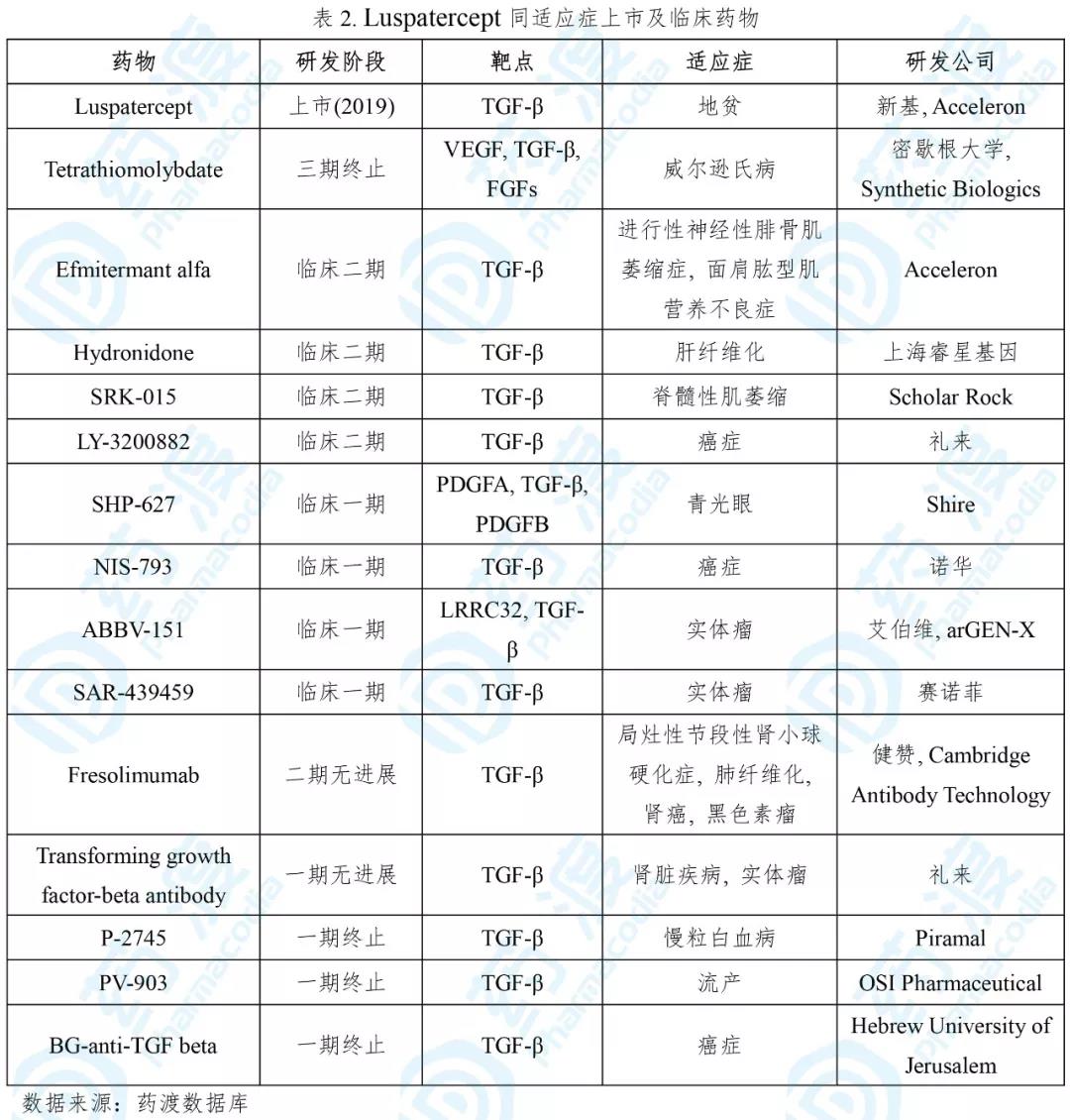
Luspatercept-aamt已经于2019年11月08日获得FDA批准,用于治疗需要定期进行红细胞移植的β-地贫,商品名为Reblozyl®。该药最初由Acceleron研发,之后授权给新基公司[5]。
正常人血红蛋白是由2条α珠蛋白和2条β珠蛋白组成。β-地贫是由于编码β珠蛋白的基因发生缺陷或突变,β珠蛋白合成量降低,而α珠蛋白过剩并以包涵体的形式诱导红细胞凋亡。该病的世界范围内发病率为1/100000,欧盟区为1/10000,而塞浦路斯(发病率14%)、撒丁岛(10.3%)、东南亚等国家和地区最为严重[6]。目前,长期输血联合铁螯合剂、造血干细胞移植是主要的治疗方案,但分别存在铁沉积和HLA配型困难等缺点。
Reblozyl®是一种靶向TGF-β家族配体的重组融合蛋白,可以降低Smad2/3信号通路作用。该药通过促进晚期前体红细胞的分化,提升红细胞的增生能力[7]。
Reblozyl®获批是基于一项多中心、随机、双盲、安慰剂对照试验(NCT02604433)。纳入地贫患者336位,按2:1接受Reblozyl®或安慰剂。治疗组有21%患者的输血量降低至少33%,而安慰剂组仅有4.5%的患者达到该指标(p<0.0001)[7]。
Reblozyl®是首个在美国获批上市的促红细胞成熟药物,可以缓解病人对输血的依赖。
03
Cefiderocol Sulfate Tosylate
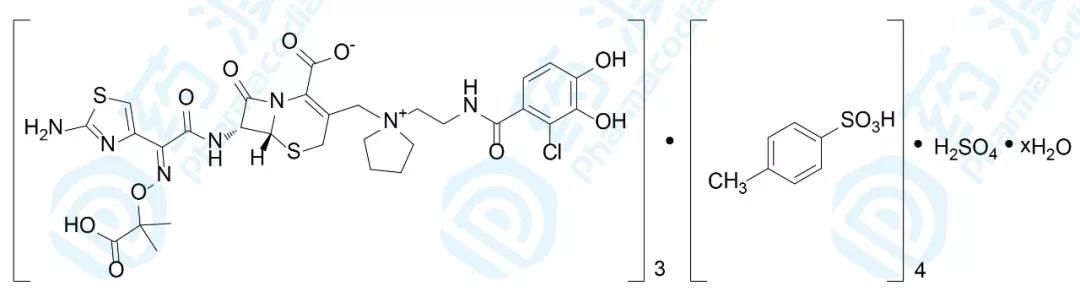
Cefiderocol由盐野义制药开发,于2019年11月14日获得FDA批准上市,用于治疗复杂尿路感染(cUTI),商品名为Fetroja®。此外,该药还于2019年4月向欧盟EMA递交了上市申请[8]。
cUTI常见的致病菌包括大肠杆菌、克雷伯氏菌、假单胞菌等革兰氏阴性菌,肠球菌等部分革兰氏阳性菌,主要表现为泌尿生殖系统的结构和功能异常[9]。临床上常采用广谱抗生素、手术和导尿等方案处理[10]。
![临床上常采用广谱抗生素、手术和导尿等方案处理[10]。](https://cimg.cphi.cn/img_Cphi_cn/news/2019_12/Mimg_1912090314870504.jpg)
Cefiderocol是一种针对革兰氏阴性菌的头孢菌素类抗生素药物,并作为铁载体吸附胞外游离的铁元素。Cefiderocol可以通过孔道蛋白进行被动扩散或者通过铁载体主动运输机制,进入细菌的周质间隙。Cefiderocol是通过与青霉素结合蛋白家族(PBPs)结合,抑制细菌细胞壁的生物合成[11]。
Cefiderocol的获批是基于一项国际多中心、随机、双盲试验(NCT02321800),448位cUTI住院病人按照2:1接受cefiderocol或imipenem/cilastatin治疗。结果显示,在治疗第7天时,cefiderocol组有72.6%的患者达到细菌学清除和临床缓解,而对照组为54.6%[11]。
由革兰氏阴性细菌引起的cUTI导致的高死亡率是医学上的挑战,盐野义公司相信Fetroja®将成为最佳药物治疗选择之一。
04
Zanubrutinib
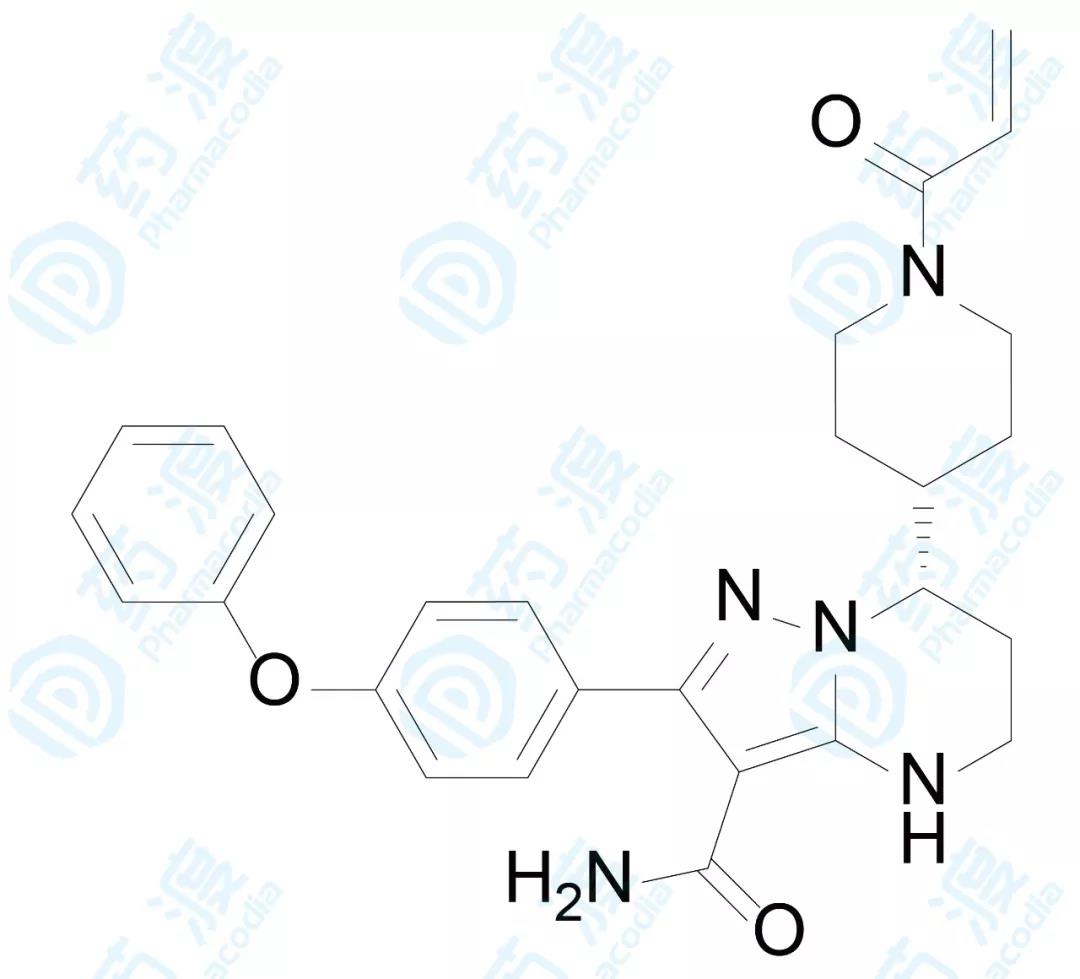
百济神州研发的泽布替尼已经于2019年11月14日获FDA批准上市,用于治疗成人套细胞淋巴瘤(MCL),商品名为BrukinsaTM [12]。
MCL是一种B细胞非霍奇金淋巴瘤,主要发病人群为中老年。MCL从淋巴结开始,逐渐向脾 脏、骨髓、血液,甚至食道、肠胃等部位扩散。根据美国癌症协会统计,MCL约占淋巴瘤的5%[13]。
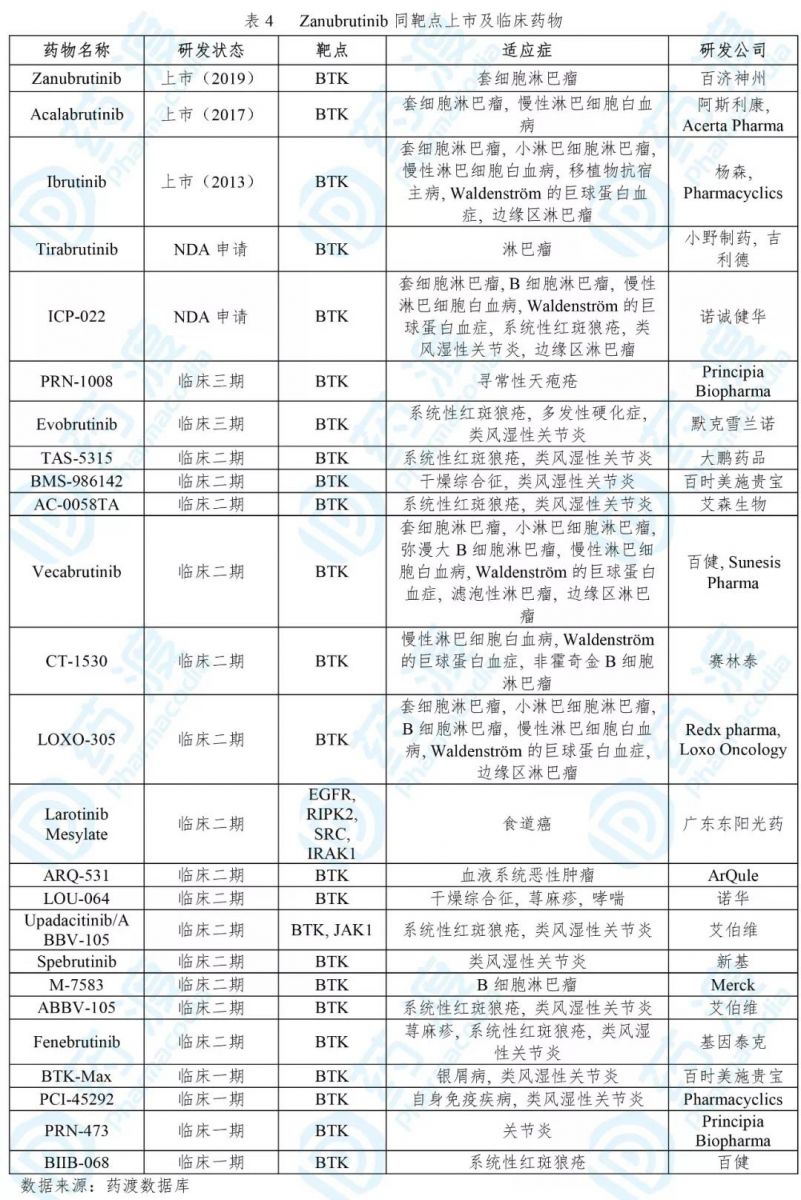
BrukinsaTM是一种小分子BTK(Bruton酪氨酸激酶)抑制剂,可阻断相关信号传递,从而抑制恶性增殖B细胞的生长并杀死肿瘤细胞[14]。
BrukinsaTM的获批是基于一项临床二期、开放标签、多中心、单臂试验(NCT03206970),纳入既往治疗过的MCL病人86位。结果显示,84%的病人实现瘤块缩小,中位总缓解期为19.5个月。另一项单臂试验(NCT02343120)纳入32位病人,84%病人瘤块缩小,中位总缓解期为18.5个月[14]。
BrukinsaTM不仅突破了伊布替尼对其他靶点的副作用,也极大改善了药物耐受浓度。我国自2015年以来实行药政改革,提高了大批国内药企的研发热情。基于国内政策利好的大环境,BrukinsaTM成为首个走向海外的中国原研新药。
05
Crizanlizumab
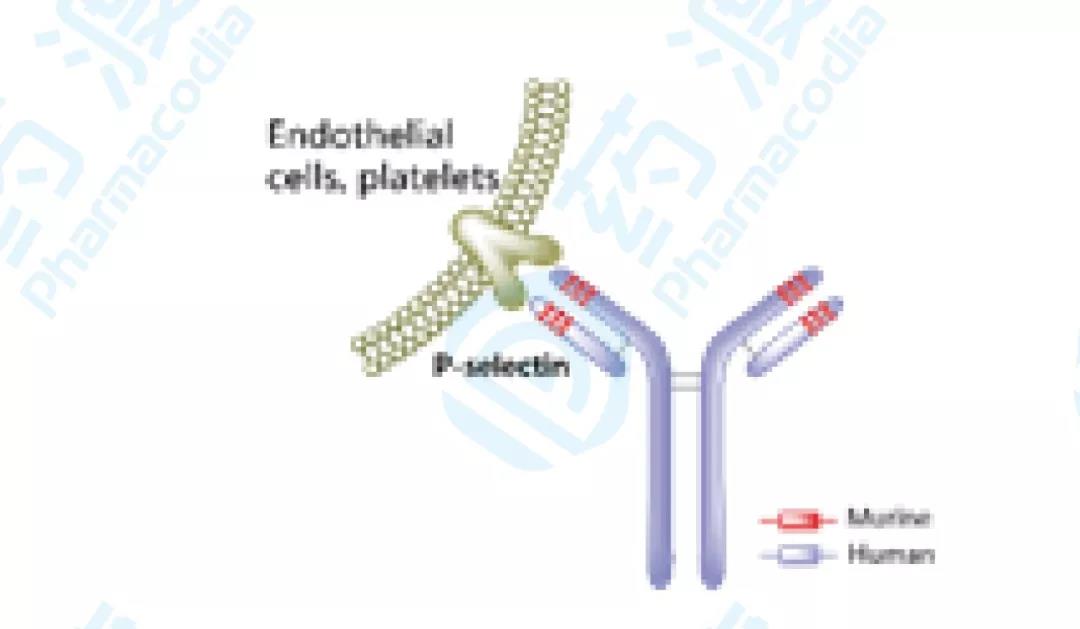
Crizanlizumab已经于2019年11月15日获得FDA批准,该药由Selexys Pharma公司(2012年被诺华收购)开发,用于治疗镰状细胞病患者的血管闭塞危象(VOCs),商品名为Adakveo®[15]。
镰状细胞贫血是一种复杂、衰竭性血液遗传病,累及范围不仅限于红细胞。临床表现为慢性炎症、P-选择素等细胞粘附蛋白增多、细胞凝聚、血流堵塞等,导致血管闭塞危象(VOCs)及其他危及生命的并发症。VOCs是镰状细胞贫血患者住院的主要诱因,美国每年约有20万例ER急救[16]。
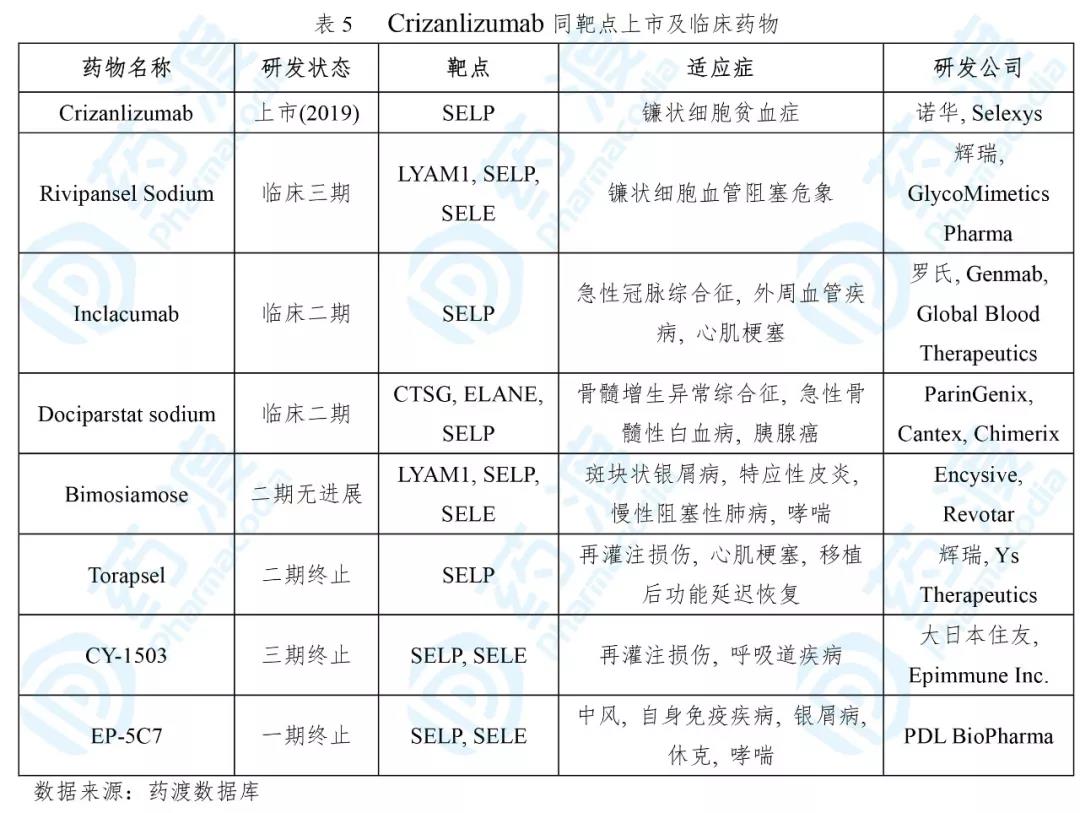
Adakveo®是一种靶向P-选择素的人源化IgG2 kappa型单克隆抗体,可以阻断P选择素与其配体如PSGL-1等的相互作用。Adakveo®通过与活化内皮细胞和血小板上的P选择素结合,抑制内皮细胞、红细胞和白细胞的凝聚[17]。
Adakveo®获批是基于一项SUSTAIN临床研究(NCT01895361)。治疗组和安慰剂组相比,VOC年发生率中位数较低(1.63 vs. 2.98,p = 0.010)。治疗组约有36%的病人发生VOC事件,而安慰剂组为17%。治疗组和安慰剂组首次出现VOC的中位时间分别为4.1个月和1.4个月[17]。
Adakveo®是首个靶向P-选择素的单抗药物,对于SCD领域的药物研发具有启发意义。
06
Givosiran
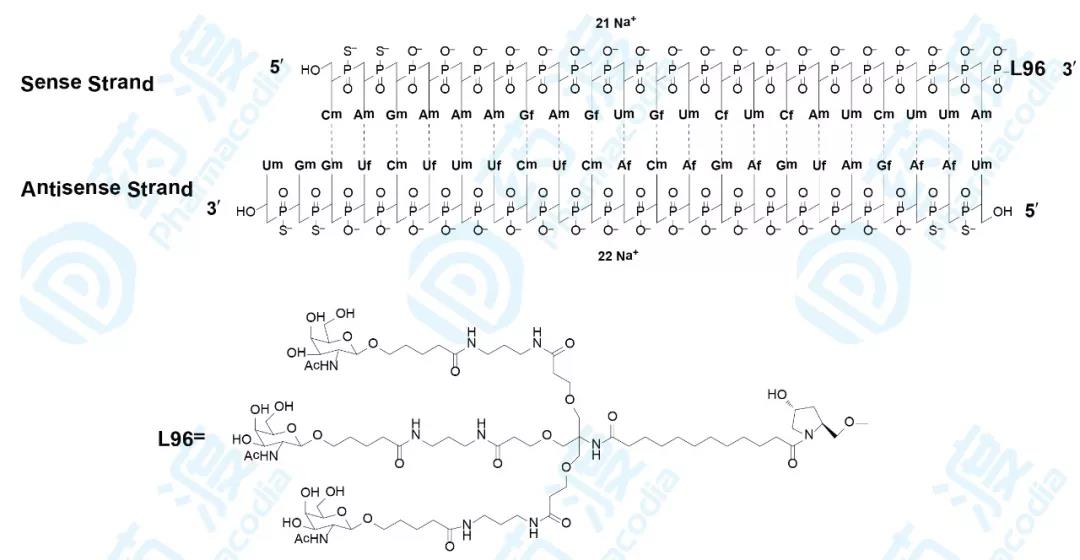
Alnylam研发的givosiran已经于2019年11月20日获得FDA批准,用于治疗成人急性肝卟啉症(AHP),商品名为Givlaari®[18]。
AHP是一种极为罕见的遗传病,危及病人生命和生活质量。AHP有四种类型:急性间歇性卟啉症(AIP)、遗传性粪卟啉症(HCP)、多变性卟啉症(VP)和常染色体隐性遗传的5-氨基乙酰丙酸脱水酶缺陷型卟啉症(ADP)。AHP的整体发病率为5/10万人,AIP、HCP和VP的遗传外显率很低,约90%以上携带致病性突变的杂合子可无症状生存[19]。
![约90%以上携带致病性突变的杂合子可无症状生存[19]。](https://cimg.cphi.cn/img_Cphi_cn/news/2019_12/Mimg_1912090314786458.jpg)
Givlaari®是一种5-氨基乙酰丙酸合酶1(ALAS1)导向的小干扰RNA,可通过RNA干扰的方式来降低肝细胞内升高的ALAS1 mRNA水平[20]。
Givlaari®获批是基于一项随机、双盲、安慰剂对照的国际试验(NCT03338816)。纳入AHP病人94位,按照1:1进入治疗组或安慰剂组。与安慰剂相比,Givlaari®组的卟啉发作降低70%[20]。
RNAi技术曾被《Science》杂志评为2001年的十大科技进展。2018年8月,Alnylam推出世界首款RNAi药物patisiran,而givosiran的获批和其他在研药物展示出Alnylam的领先地位。Patisiran和givosiran将药物研发推向了新的层次,从RNA角度攻克人类疾病。
07
Cenobamate
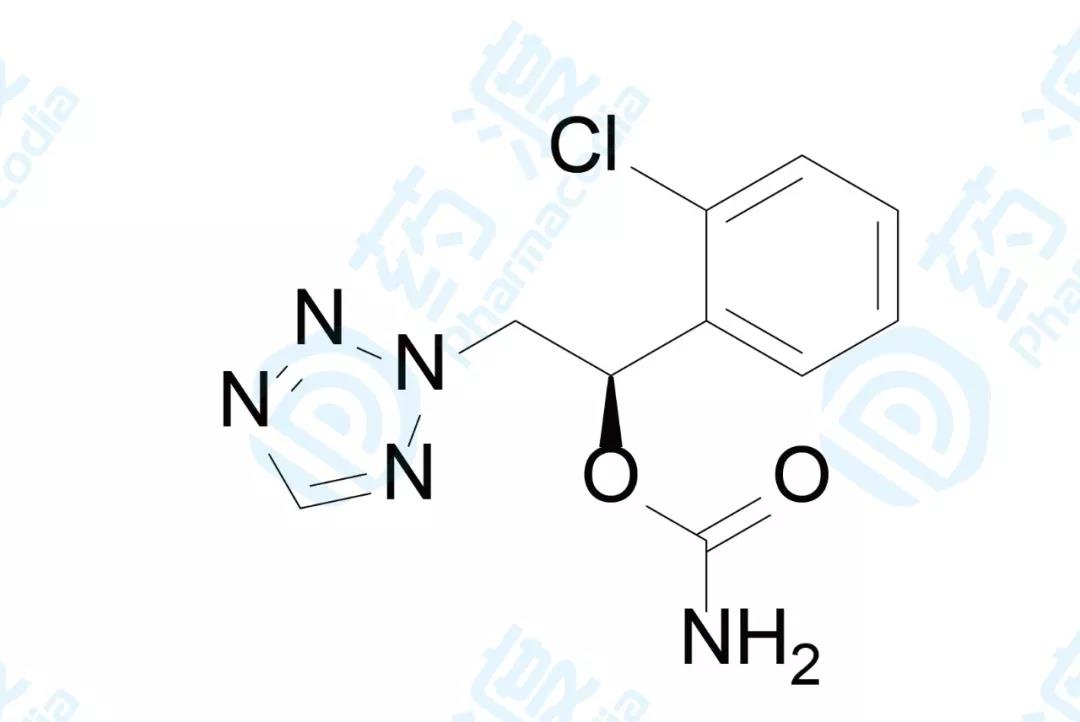
SK biopharma开发的Cenobamate已经于2019年11月21日获FDA批准,用于治疗部分发作性癫痫,商品名为Xcopri®[21]。
癫痫是一种短暂的脑部异常电位活动,可以引起不受控制的活动、异常思考、行为和感觉等。局部癫痫常常起始于脑部的受限位点。根据美国CDC统计,美国约有300万癫痫患者,其中60%的病人采取AED药物后依然发作[22]。
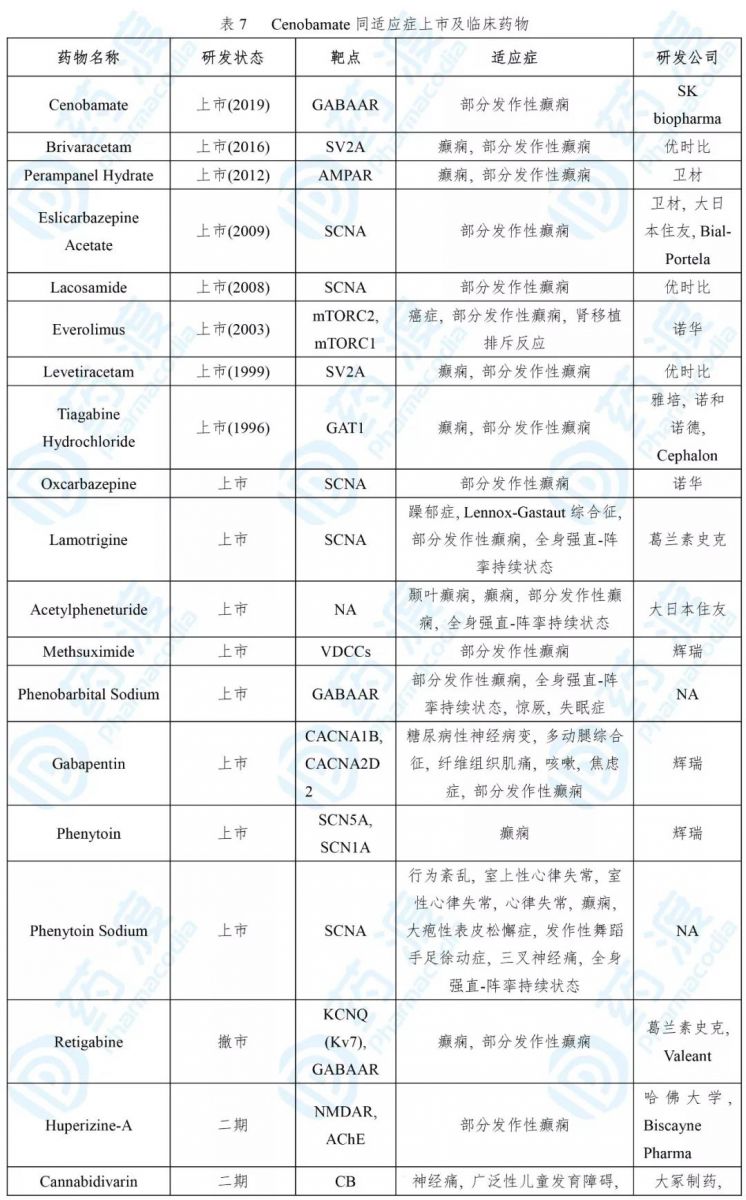
Cenobamate通过抑制电压门控钠流进而降低重复性神经元放电,同时也是γ-氨基丁酸(GABA)离子通道的正别构调节剂。然而,cenobamate治疗癫痫的具体机制尚不清楚[23]。
Cenobamate的安全性和疗效性评估是基于两项随机、双盲、安慰剂对照试验,纳入病人655位(试验1,NCT01866111;试验2,NCT01397968)。试验1中,200 mg治疗组和安慰剂组在28天时的癫痫频率中位数分别下降55.6%和21.5%(p< 0.0001);试验2中,安慰剂组下降24.3%,100 mg组下降36.3%(p= 0.006),200 mg组下降55.2%(p< 0.001),400 mg组下降55.3%(p< 0.001)[23]。
Xcopri®是韩国首个获得FDA批准的创新药物,为局部癫痫治疗提供新的选择。
08
Voxelotor
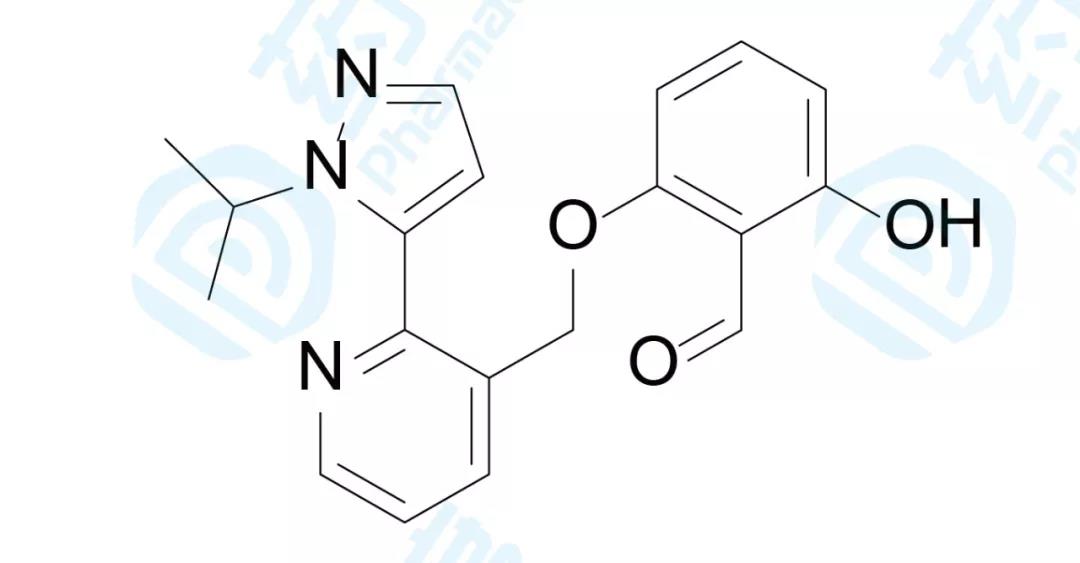
Voxelotor已经于2019年11月25日获FDA批准,用于治疗成人和12岁及以上儿科患者的镰状细胞贫血症(SCD)。该药由Global Blood Therapeutics研发,商品名为Oxbryta®[24]。
在美国有近10万人受SCD影响,全球约有数百万人受累及,尤其是非洲地区[25]。SCD是一种遗传性血液病,表现为血红蛋白异常并聚合,红细胞呈现镰刀状,降低红细胞的供氧能力[26]。
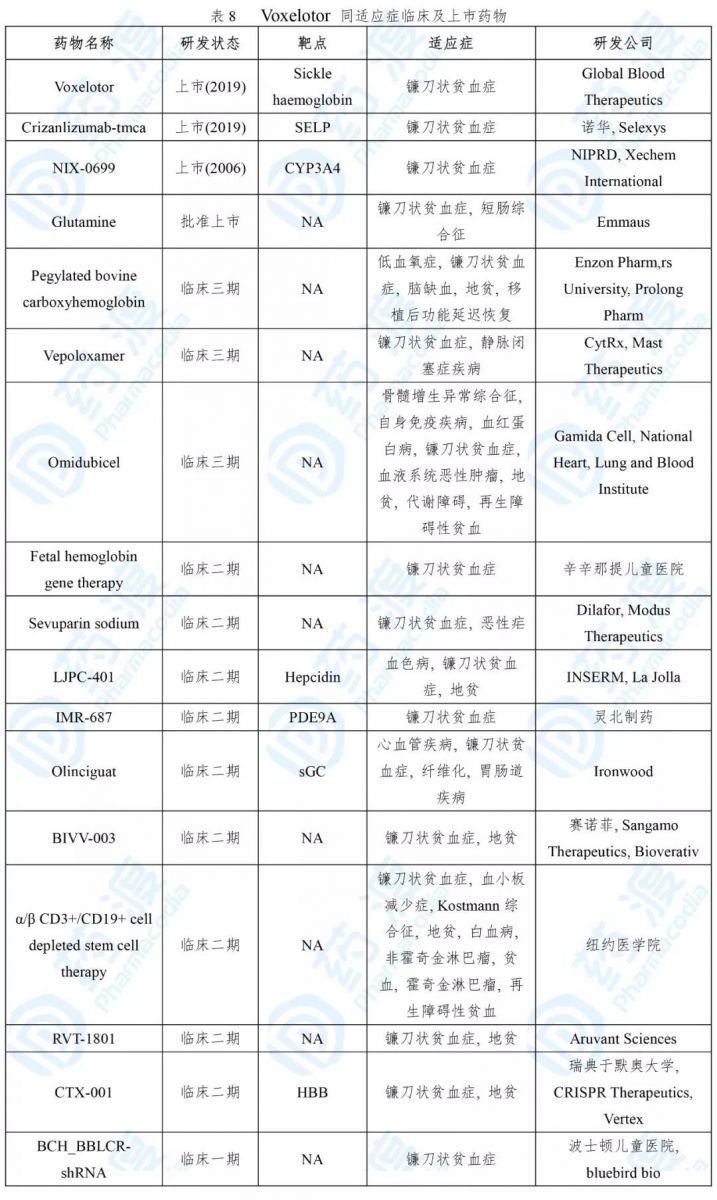
Oxbryta®是一种镰状血红蛋白(HbS)阻聚剂,与HbS按照1:1结合,通过提高血红蛋白对氧的亲和力进而抑制聚合作用[27]。
Oxbryta®获批是基于一项随机、双盲、安慰剂对照、多中心试验(NCT 03036813)。274位病人分别接受Oxbryta® 1500 mg、900 mg和安慰剂治疗。1500 mg治疗组的血红蛋白缓解率为51.1%,而安慰剂组为6.5%(p < 0.001)[27]。
本月度,FDA批准两个用于SCD的药物。Adakveo®是从细胞凝聚角度缓解VOC症状,而Oxbryta®是从血红蛋白角度缓解蛋白凝聚。



合作咨询
![]() 肖女士
肖女士
![]() 021-33392297
021-33392297
![]() Kelly.Xiao@imsinoexpo.com
Kelly.Xiao@imsinoexpo.com
 2006-2025 上海博华国际展览有限公司版权所有(保留一切权利)
沪ICP备05034851号-57
2006-2025 上海博华国际展览有限公司版权所有(保留一切权利)
沪ICP备05034851号-57