新药定义更替
改革开放以来,我国多次对新药的定义进行变更。
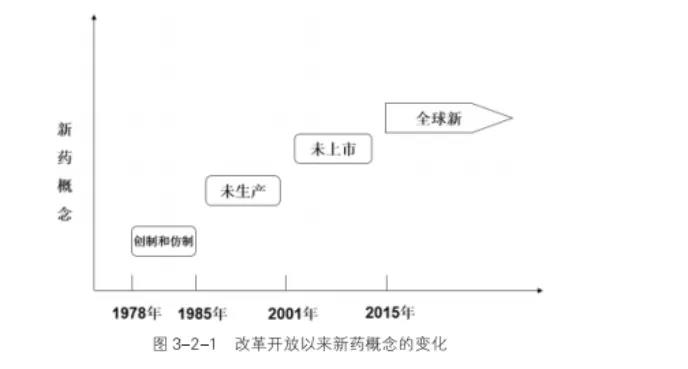
1979年-1985年新药定义:“我国创制和仿制的中西药品”
1985年-2002年新药定义:“我国未生产过的药品”
2002年-2007年新药定义:“未曾在中国境内上市销售的药品”
2007年-2015年新药定义:“未曾在中国境内上市销售的药品。已上市药品改变剂型、改变给药途径、增加新的适应症的,按照新药申请程序申报。”
2016年至今:“全球新”和“改良新”
我国对新药的定义经历了多次变更,新药的定义从 1985 年“我国未生产过的药品”,到 2002 年更改为“ 曾在中国境内上市销售的药品”,直到 2015 年才确定为“未在中国境内外上市销售的药品”,新药从“中国新”到“全球新”的转变,整整摸索了 30 年。通过不断的改革,我国对创新药、改良型新药、仿制药才有了最清晰的认识。
化药新药注册情况
1985年7月1日,卫生部制定并正式颁布了《新药审批办法》,新药由卫生部集中统一审批,各省级卫生行政部门为初审单位。新药审评和审批工作从地方集中到中央以来,无论是申报新药数量或批准生产的数量,均取得了快速的增长。
1986年全国申请临床的新药共38种,其中西药28种。卫生部批准上临床的西药仅3种,它们是甲磺吡脲及其片剂和**氯化铭注射液。属于第四、五类新药,由省、自治区、直辖市卫生厅、局审批的共16种,其中西药9种。自1985年《新药审批办法》施行10年来,卫生部共批准新药3,251件,1530个品种;其中西药2,062件,888个品种,每年均呈良好的增长趋势。
1998年,国家药品监督管理局挂牌成立,2000年国家药品监督管理局药审中心官方网站正式上线。在新药领域,2001-2006年新药申报数量快速增长, 2007年恢复至正常的状态。
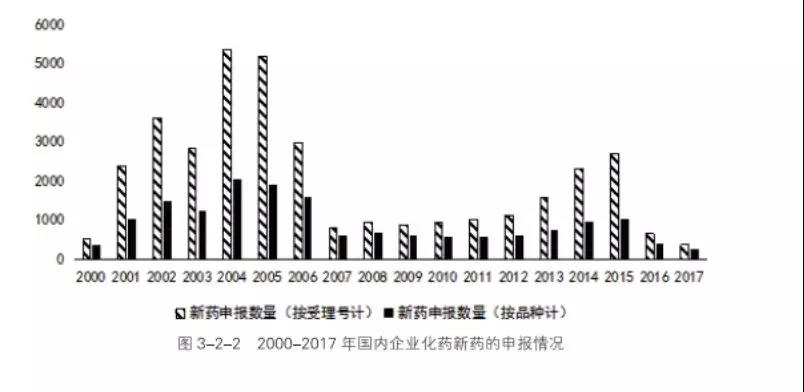
2000-2017年化药新药申报在治疗领域方面,系统用抗感染药申报的数位居第一,其次是消化道及代谢,近年来大热的抗肿瘤药排在了第四位。
创新型新药发展之路
2016年3月,国家食品药品监督管理总局发布的 《关于发布化学药品注册分类改革工作方案的公告》(2016年第51号)明确提出注册分类第1类为创新药,境内外均未上市的创新药指含有新的结构明确的、具有药理作用的化合物,且具有临床价值的药品。

从定义来看,2007年版《药品注册管理办法》附2中规定的化药药品注册分类的1.1类也为创新药:
1. 未在国内外上市销售的药品:
(1) 通过合成或者半合成的方法制得的原料药及其制剂;
就创新药的申报来看,受到两次药品核查风暴的影响比较小。2009年后申报创新药临床的数量保持增长,2017年突破100个品种。但是申报上市的品种少。
创新药物申报区域集中在长三角 北京、广东、山东地区。2017年药审中心 完成审评的化药IND申请有542件,审评通过批准的IND 申请有481件,其中批准创新药临床试验申请有399件(共涉及170个品种)。近年来IND申报增长较快,即使7.22核查,药品研发政策改变,对IND并没有太大的负面影响。
改良型新药发展之路
2016年3月国家食品药品监督管理总局发布的《关于发布化学药品注册分类改革工作方案的公告》中,首次提出了改良型新药的说法。境内外均未上市的改良型新药指在巳知活性成份的基础上,对其结构、剂型、处方工艺、给药途径、适应症等进行优化,且具有明显临床优势的药品。
创新药新药的审评审批,重点在物质基础原创性和新颖性基础上,强调临床价值的要求,而改良型新药要求比改良前具有明显的临床优势。从”改”到“良",从“为创新而创新”到“为临床价值而创新”,即一个改良型新药要比原来的药物做得更好,本身并不容易。
全球新药研发失败的风险越来越高,开发新靶点的NME药物也越来越难。在当前国家大力鼓励创新药研发的大背景下,改良型新药具有“高成功率、高收益、低风险”等特点。
全球新药研发成功率数据显示,改良型新药的研发成功率最高,相较于新化学实体药和生物药,改良型新药的成功率为新分子实体 (Newmolecular Entity, NME) 的3.6 倍、生物药的2倍。基于上述优势,改良型新药发展迅猛,已成为全球新药研发的主流。
按照2007年版《药品注册管理办法》中注册分类的定义,原 1.3、1.4、1.5、2、4、5类均属于改良型新药。
1. 未在国内外上市销售的药品:
(3) 用拆分或者合成等方法制得的巳知药物中的光学异构体及其制剂;
(4) 由巳上市销售的多组份药物制备为较少组份的药物;
(5) 新的复方制剂;
(6) 已在国内上市销售的制剂增加国内外均未批准的新适应症。
2. 改变给药途径且尚未在国内外上市销售的制剂。
4. 改变已上市销售盐类药物的酸根、碱基(或者金属元素),但不改变其药理作用的原料药及其制剂。
5. 改变国内巳上市销售药品的剂型,但不改变给药途径的制剂。
根据申报的类型,改良型新药可分为三类:1. 改异构体、改盐、改酯2. 改剂型3. 新复方。
新2类改良型新药的诞生,让不少企业有些猝不及防,特别是新2.1和2.2类中原属于4、5类化药里的内容引发不少争议。新的政策意味着原来唾手可得的简单改剂型及改酸根改碱基的申报现在变得无比艰难,却对规范我国制药行业有着深远的意义。
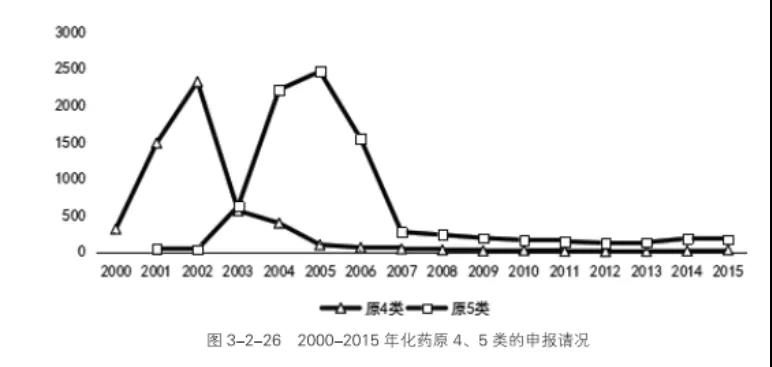
2002年《药品注册管理办法》(试行)颁布以来,从2003年起至2006年,化药原4、5类大量申报。直到2007年由药品注册核查、停止简单改剂,申报情况才得以恢复正常。



合作咨询
![]() 肖女士
肖女士
![]() 021-33392297
021-33392297
![]() Kelly.Xiao@imsinoexpo.com
Kelly.Xiao@imsinoexpo.com
 2006-2025 上海博华国际展览有限公司版权所有(保留一切权利)
沪ICP备05034851号-57
2006-2025 上海博华国际展览有限公司版权所有(保留一切权利)
沪ICP备05034851号-57