三、中国1类新药NDA/BLA申请概况
2019年11月,国家药品监督管理局(NMPA)药审中心共承办了2个中国1类新药的NDA申请和1个中国1类新药的BLA申请.
01、索凡替尼胶囊
索凡替尼 (HMPL-012) 是由和记黄埔医药自主研发的,口服新型血管免疫激酶抑制剂,选择性靶向血管内皮生长因子受体(VEGFR),成纤维细胞生长因子受体(FGFR)和集落刺激因子-1受体(CSF-1R)。2019年11月,国家药品监督管理局(NMPA,原CFDA)受理了和记黄埔提交的索凡替尼用于治疗晚期非胰 腺神经内分泌瘤的NDA申请。此外索凡替尼还处于治疗胆道癌的临床二/三期,治疗甲状腺癌的临床二期,以及治疗实体瘤的临床一期研究阶段。
临床结果
在对实体瘤的临床I期研究(NCT02133157)中,索凡替尼凸显了对神经内分泌瘤(NET)的显著疗效。在全部34例患者中,有21例NET患者,治疗有效率38.1%、疾病控制率85.7%,中位无进展生存期16.9个月。
2017年,索凡替尼对NET的临床II期研究(NCT02267967)结果在欧洲神经内分泌肿瘤学会(ENETS)年会上公布,81例NET患者中,有41例为PNET,65%为既往系统治疗失败的患者。截止2017年1月20日,索凡替尼对胰 腺神经内分泌肿瘤有效率为 17.1% (7/41),疾病控制率为90.2%,预计胰 腺神经内分泌肿瘤的中位无进展生存为19.4个月。2
参考
1. Sulfatinib, a novel kinase inhibitor, in patients with advanced solid tumors: results from a phase I study,Oncotarget. 2017 Jun 27;8(26):42076-42086. doi: 10.18632/oncotarget.14942.
2. An open-label Phase Ib/II study of sulfatinib in patients with advanced neuroendocrine tumors (NCT02267967), ENETS 2017), Abstract #1697.
02、奥布替尼片
奥布替尼是诺诚健华医药研发的BTK抑制剂,目前其用于治疗慢性淋巴细胞白血病(CLL)和小淋巴细胞淋巴瘤(SLL)的新药上市申请(NDA)已被中国国家药品监督管理局(NMPA)受理。此外,本品也正在进行治疗类风湿性关节炎(RA)和系统性红斑狼疮(SLE)的一期临床研究以及联合重组人源化II型CD20单克隆抗体MIL62注射液治疗复发/难治CD20+ B细胞淋巴瘤的一期临床研究。同时,本品还拟用于治疗套细胞淋巴瘤(MCL)和复发难治性边缘区淋巴瘤(MZL)、华氏巨球蛋白血症等。
研发里程碑
2019年11月20日,诺诚健华宣布,中国国家药品监督管理局(NMPA)已受理奥布替尼(ICP-022)用于治疗复发/难治慢性淋巴细胞白血病(CLL)/小淋巴细胞淋巴瘤(SLL)患者的新药上市申请(NDA)。
2019年5月,在美国的IND通过FDA审评。
2019年2月,评价ICP-022治疗复发或难治华氏巨球蛋白血症的临床II期试验(CTR20190364)拟在中国开始。
2019年1月,一项对复发难治边缘区淋巴瘤的II期临床研究计划2019年2月在中国开始。
2018年4月,对复发/难治性CLL或者SLL患者的临床I/II期试验(NCT03493217、CTR20180263、ICP-CL-00103)在中国开始,预计将于2020年12月完成。
2018年2月,一项评价ICP-022 治疗复发或难治性套细胞淋巴瘤安全性和有效性的多中心、开放性的临床I/II试验(NCT03494179、ICP-CL-00102、CTR20180196)在中国开始,预计将于2020年12月完成。
2017年7月,一项随机、双盲、安慰剂对照的单中心剂量递增临床I期试验(NCT03189017)在澳大利亚RA和SLE患者中启动,于2017年12月公开消息显示,ICP-022在该研究中显示了良好的安全性和药代药效动力学特性,对治疗类风湿关节炎和系统性红斑狼疮具有良好前景。
2017年6月12日,北京诺诚健华医药科技有限公司首次向中国食品药品监督管理总局(CFDA)提交临床试验申请(化药1类),并于2018年12月19日,获得CFDA批准开展针对系统性红斑狼疮(SLE)和类风湿关节炎(RA)的临床试验。
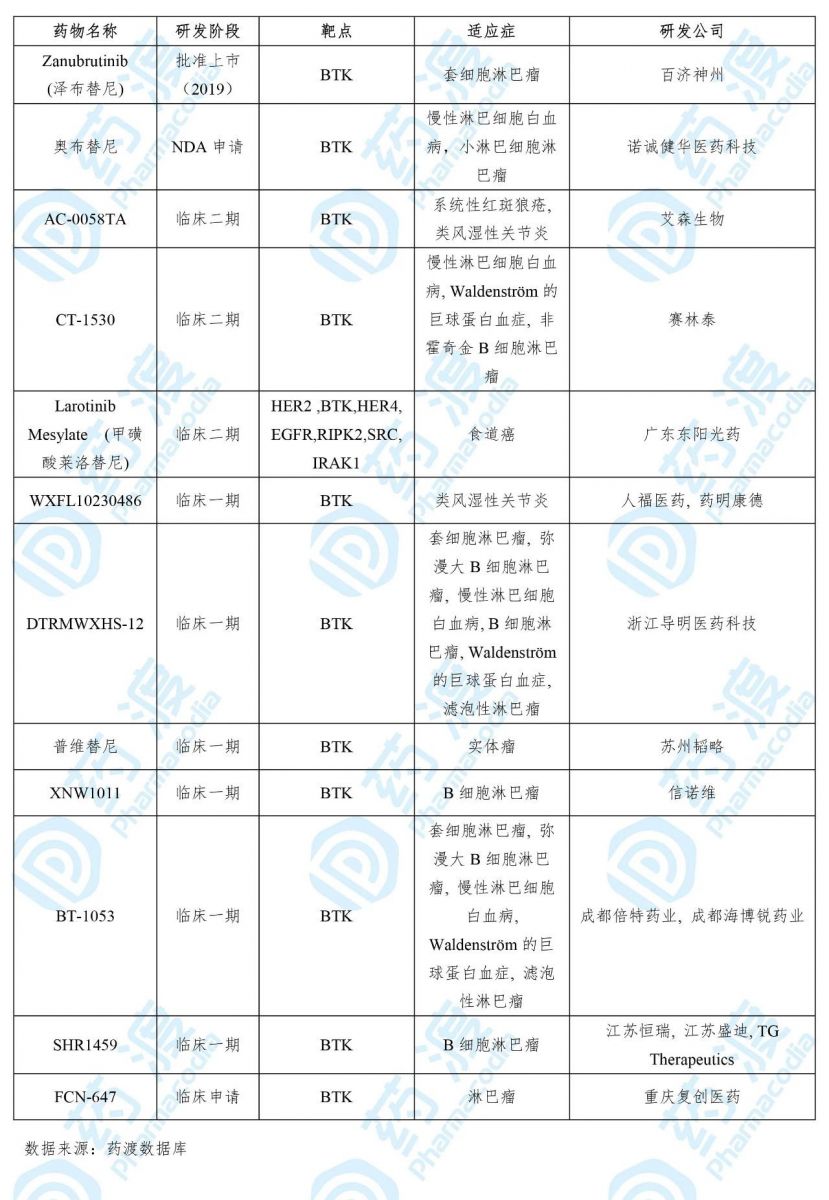
目前靶向BTK的中国1类药物如下表所示:
03、注射用泰它西普
泰它西普(泰爱)是烟台荣昌制药股份有限公司开发的一种融合蛋白,由跨膜激活剂及钙调亲环素配体相互作用分子(TACI)的BLyS/APRIL结合区和人免疫球蛋白Fc片段融合而成。2019年11月,中国国家药品监督管理局(NMPA)受理荣昌制药提交 的泰它西普用于治疗系统性红斑狼疮的BLA申请。此外该药用于治疗类风湿性关节炎(RA)和视神经脊髓炎谱系疾病(NMOSD)处于临床三期研究阶段,而治疗干燥综合征处于临床二期研究阶段。
临床结果
自2011年4月获得CFDA批准进行难治性类风湿性关节炎和系统性红斑狼疮临床研究以来,经过I、II期临床研究,显示出良好的安全性。1
2019年7月,荣昌生物发布R-C18(泰它西普)临床试验结果:系统性红斑狼疮关键临床试验达到主要终点。这一关键临床试验于2015年启动,是一项多中心、随机、双盲、安慰剂对照的研究,共入组249例SLE患者,评价泰它西普治疗SLE受试者的疗效和安全性。结果显示,泰它西普治疗组与安慰剂对照组之间临床应答率(系统性红斑狼疮反应指SRI4)差异显著,在统计学具有显著性差异,达到临床试验主要终点,其中泰它西普高剂量组48周应答率达到79.2%,安慰剂对照组应答率为32.0%。泰它西普在安全性方面也表现优异,病人耐受性良好。2
融资及交易
2017年12月,烟台荣昌制药股份有限公司宣布完成10亿人民币战略融资,此次融资由深创投、国投创业、太盟投资集团(PAG)、龙磐投资、国投创合联合领投,以及华泰大健康基金、山东吉富创投、国中创投、鲁信创投、中泰汇银共同出资。
2009年11月30日,高投名力成长创业投资有限公司(管理机构:名信中国成长基金)投资了荣昌制药有限公司人民币3000万元,获得了17%的股权。
参考
1. 继往开来 泰爱临床又启新探索,荣昌制药,2015年10月。
2. 荣昌生物发布原创新药RC18(泰它西普)临床试验结果:系统性红斑狼疮关键临床试验达到主要终点,荣昌官微,2019年7月。
https://www.cphi.cn/news/show-176777.html2019年11月中国1类新药临床动态(上)



合作咨询
![]() 肖女士
肖女士
![]() 021-33392297
021-33392297
![]() Kelly.Xiao@imsinoexpo.com
Kelly.Xiao@imsinoexpo.com
 2006-2025 上海博华国际展览有限公司版权所有(保留一切权利)
沪ICP备05034851号-57
2006-2025 上海博华国际展览有限公司版权所有(保留一切权利)
沪ICP备05034851号-57