近几年创新药风光无限,不论是国产PD-1抗体的国内成功上市,还是BTK抑制剂泽布替尼在美国的获批,收获了一批一批的流量和赞许。然而创新药研发资金投入量大、耗时长、风险高,同时还面临未来市场推广失败的风险。话题转向仿制药,更是一片热议。一致性评价、两票制、4+7集采则让仿制药价格大幅下跌,仿制药企业回归制造业公司属性的趋势已经势不可挡。
药企新的增长点在哪? 可以接受的成本投入和相对可控的研发风险项目以及高商业价值项目在哪? 505(b)(2)项目提 供了一条新的思路。 美国国会1984年通过了《药品价格竞争和专利期修正案》(Hatch-Waxman Amendment),修订后的《联邦食品、药品和化妆品法案》505部分为改良新药注册申请提供了三条渠道,具体类别与获批大概形势如下图1。
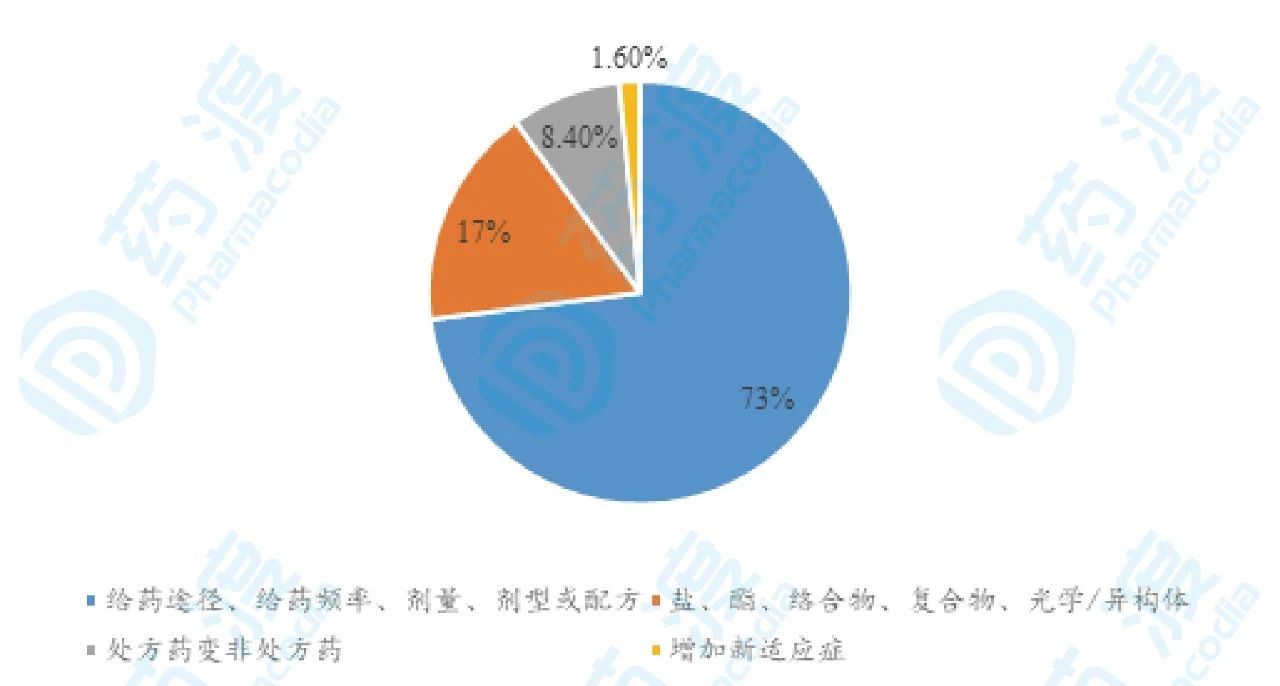
图1.505(b)(2)获批总体形势图
大多数NCE或NME采用505(b)(1)申请路径,通过505(b)(2)渠道进行注册申请的主要是增加适应症以及已获批适应症的改良。在505(b)(2)药物的发展历史上,阿瑞匹坦纳米晶、亮丙瑞林长效注射微球、依达拉奉治疗肌萎缩性脊髓侧索硬化症等开发实例无不闪耀着医药人智慧的光芒。从近10年化药505(b)(1)和505(b)(2)的获批数目趋势图,505(b)(2)大有甩开505(b)(1)的倾向。在这些通过505(b)(2)路径获批的药物中,利培酮的上市后改良过程极好的诠释了药物505b(2)路径实现商业成功的立项依据与思路。这对于国内目前2类新药立项申报是一个非常好的参考对象。
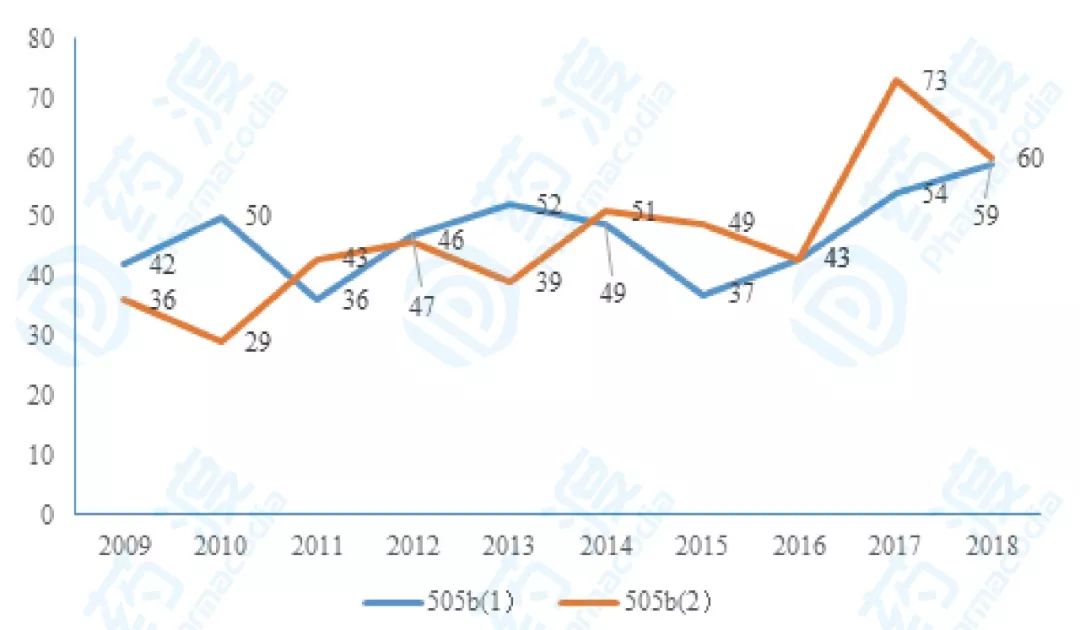
图2.近10年505(1)和(2)NDA获批数目走势图
一、利培酮改良第一春
利培酮由杨森(强生的子公司)研发并于1993年12月29日获美国食品药品监督管理局(FDA)批准上市销售,商品名为Risperidal?。通过口服片剂用于治疗**分裂症和短期治疗双相障碍的急性躁狂发作和混合发作。
在药物临床治疗老年期**分裂症的过程中发现,抗**病药的传统片剂及胶囊造成患者对药物依从性较差,口服液有如下优势,如图3所示。据统计,有50%的患者对处方制剂感到不满意;有30%的患者感片剂和胶囊难于吞咽或有吞咽困难,特别是老年人和儿童[1]。**疾病患者,尤其是急性发作者服用普通片剂十分困难,口服液可以更方便的应用于暗服药,可以减少患者护理工作的负担[2]。1996年6月10日强生利培酮口服液成功获批上市。
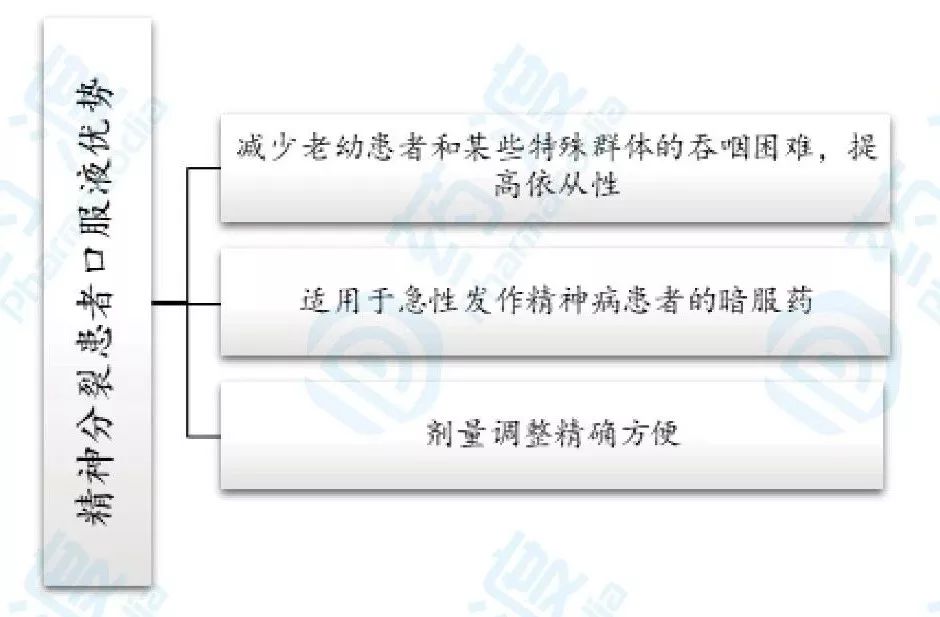
图3.**分裂症患者口服液优势总结图
二、利培酮改良第二春
2003年4月2日,利培酮口崩片获得FDA批准上市。提交此NDA的依据基于口崩片能提高对于治疗抗拒(例如吐药)或者口服吞咽困难的患者的依从性。强生公司进行了临床味觉、安全性、生物利用度、生物等效性研究,未进行新的临床有效性研究[3]。
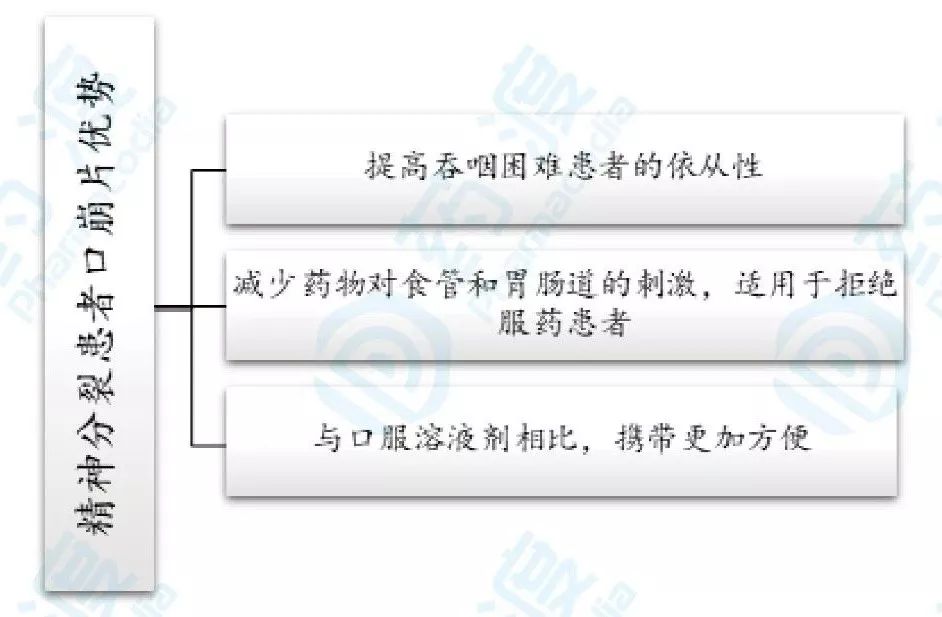
图4.**分裂患者口崩片优势总结图
三、利培酮改良第三春
虽然抗**病药物的广泛应用取得了良好的疗效,但是**分裂症复发长期困扰着临床医生及患者,复发的一大主要因素是因为药物依从性差。研究表明治疗依从性好、较长期服用维持量药物对控制病情、减少复发有积极意义。实际生活中,患者**症状缓解后,患者及家属可能会认为已经痊愈,便自行减药、停药。患者还可能因为不良发应而拒绝服药或者自知力未完全回复又无人监督看管而断药[4][5]。
2003年4月2日强生公司利培酮微球肌肉注射剂获批上市,推荐剂量为25 mg肌肉注射,每2周1次。某些患者可能需要更高的剂量,例如37.5 mg或50 mg。
提交的申报文件中临床前研究只有动物毒理学研究,其中包括了微球空白对照组。文件中还主要包括了微球制剂单剂量和多剂量药代动力学研究、微球制剂与片剂的生物等效性研究、**分裂患者体内药代动力学研究、剂量摸索、安全性和有效性研究。试验结果表明了利培酮微球制剂疗效确切,不良反应与口服片剂相似。强生在开发利培酮注射微球的同时,同时为产品申请了专利进行保护。主要相关专利如下表1。
利培酮注射微球近15年销售额如下图5所示。
![图5.Risperdal consta近15年销售额 [6]](https://cimg.cphi.cn/img_Cphi_cn/news/2019_12/Mimg_1912260150193364.jpg)
图5.Risperdal consta近15年销售额 [6]
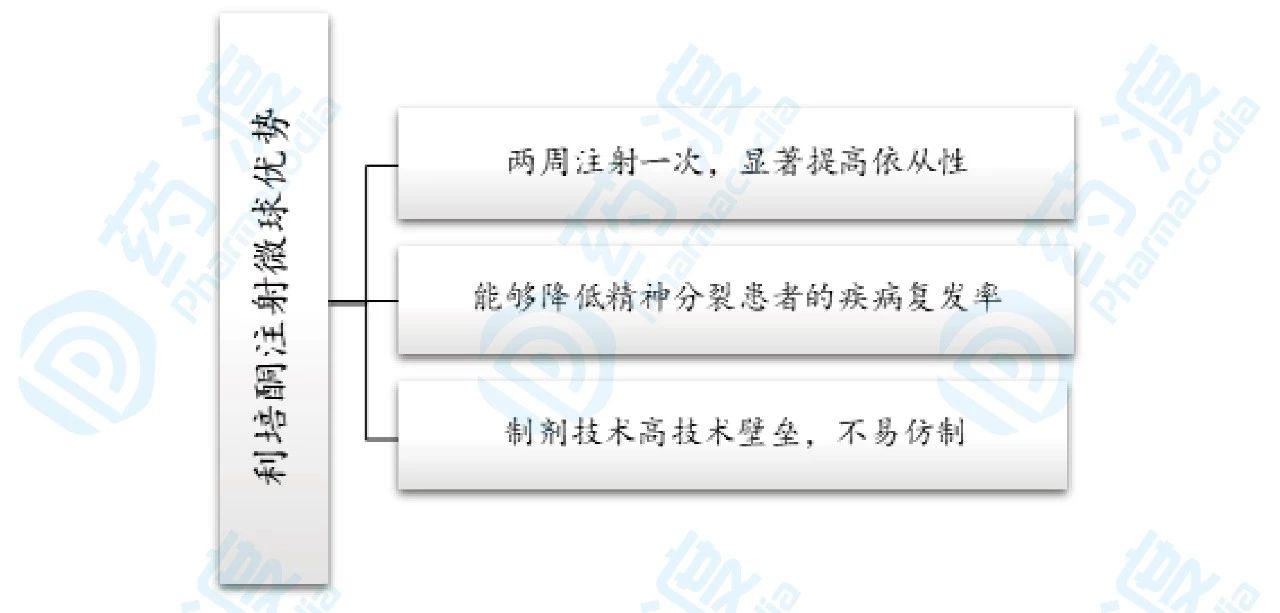
利培酮注射微球销售额逐年递增,2011年达到销售峰值15.8亿美元,之后虽然逐年下降但下降趋势缓慢,总结Risperdal consta的优势如下:
图6.利培酮注射微球优势总结图
四、利培酮改良第四春
在利培酮开发的过程中,发现利培酮的体内代谢物9-羟利培酮也具有一定的药理活性,强生在利培酮上市后开始了9-羟利培酮开发工作,最终2006年12月19日帕利哌酮获得FDA批准上市主要用于**分裂症急性期的治疗。
若帕利哌酮是普通片剂上市可能会引起关注但不太可能成为明星,但OROS技术的加持让帕利哌酮星光夺目,巨星的潜质展露无遗。帕利哌酮缓释片的剂型原理图如下图7。
图7.利培酮缓释递送系统示意图 [7]
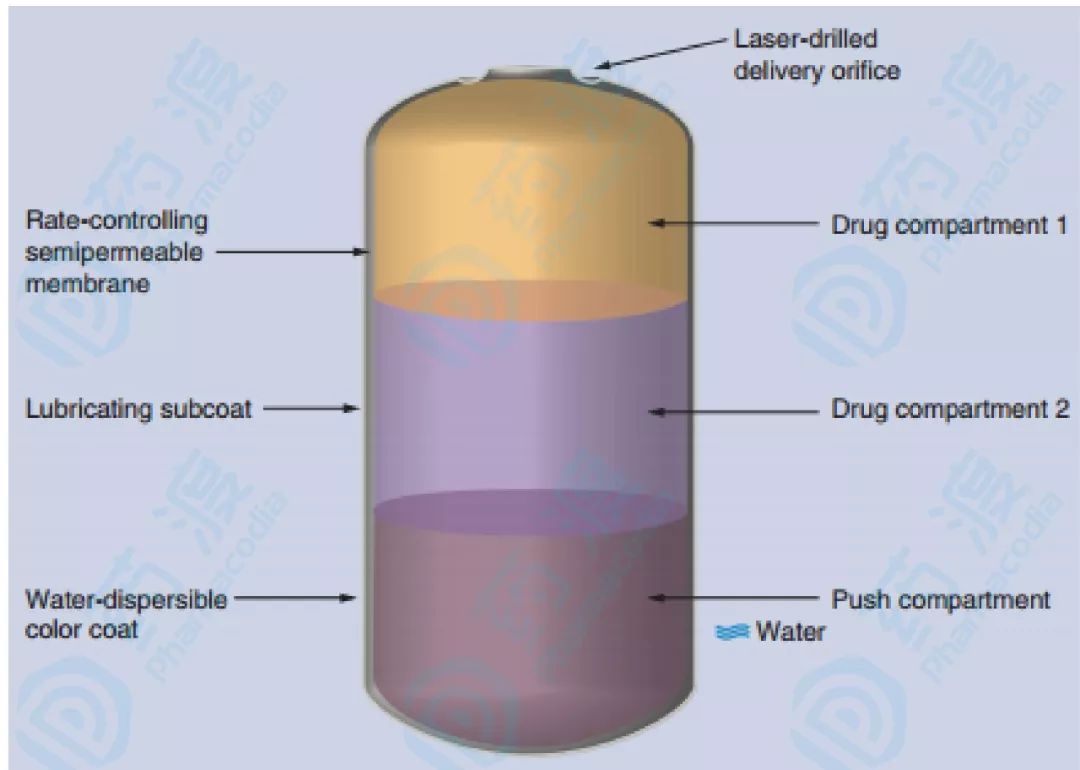
片剂一共三层,第一层和第二层两个药物层由不同的药物浓度组成(第一药物层包含较低的药物浓度),这提供了实现药物逐渐上升释放所需的浓度梯度。第一层为药物快速释放层,避免了开始服用利培酮为了测试耐受性进行剂量滴定的过程,同时缩短起效时间,快速起效。服用片剂后,消化道中的水迅速侵蚀片衣,并通过半透膜吸收。半透膜通过渗透辅料确定的渗透活性梯度控制水分进入核心的速率。当药物层变得水合时,形成帕利培酮的胶状悬浮液。然后水进入含有亲水性聚合物的推进层,聚合物水合并膨胀。这种体积膨胀“推动”药物悬浮液通过出口进入消化道。药物递送速率与膜的透水率和端口的药物浓度成正比与局部环境条件(pH,搅拌)无关。帕利培酮缓释制剂受控的释放速率造成吸收速率较慢,这导致血浆浓度逐渐上升,观察到的最大血浆浓度出现在第一次给药日给药后的24小时。在随后的治疗日,ER制剂提供了最小的血浆浓度波动。人体血药浓度图如下图8所示。
图8.帕利哌酮片单剂量平均血药浓度-时间曲线[7]
![图8.帕利哌酮片单剂量平均血药浓度-时间曲线[7]](https://cimg.cphi.cn/img_Cphi_cn/news/2019_12/Mimg_1912260150348719.jpg)
帕利哌酮缓释片的优势用下图9总结。

图9.帕利哌酮缓释片优势总结图
如果对于帕利哌酮的开发到此为此,也无可厚非,毕竟帕利哌酮缓释片已经光芒四射,但强生并未满足,其与EDT公司合作,利用纳米晶体技术开发了棕榈酸帕利哌酮注射剂,将利培酮的改良之路推向了一个新的高峰。2009年7月31日,棕榈酸帕利哌酮注射液获得FDA批准上市。初始剂量后,维持剂量每月一次。仅仅过去6年,2015年5月18日棕榈酸帕利哌酮3个月药物治疗间隔剂型成功获批上市,堪称利培酮改良之路的巅峰之作。
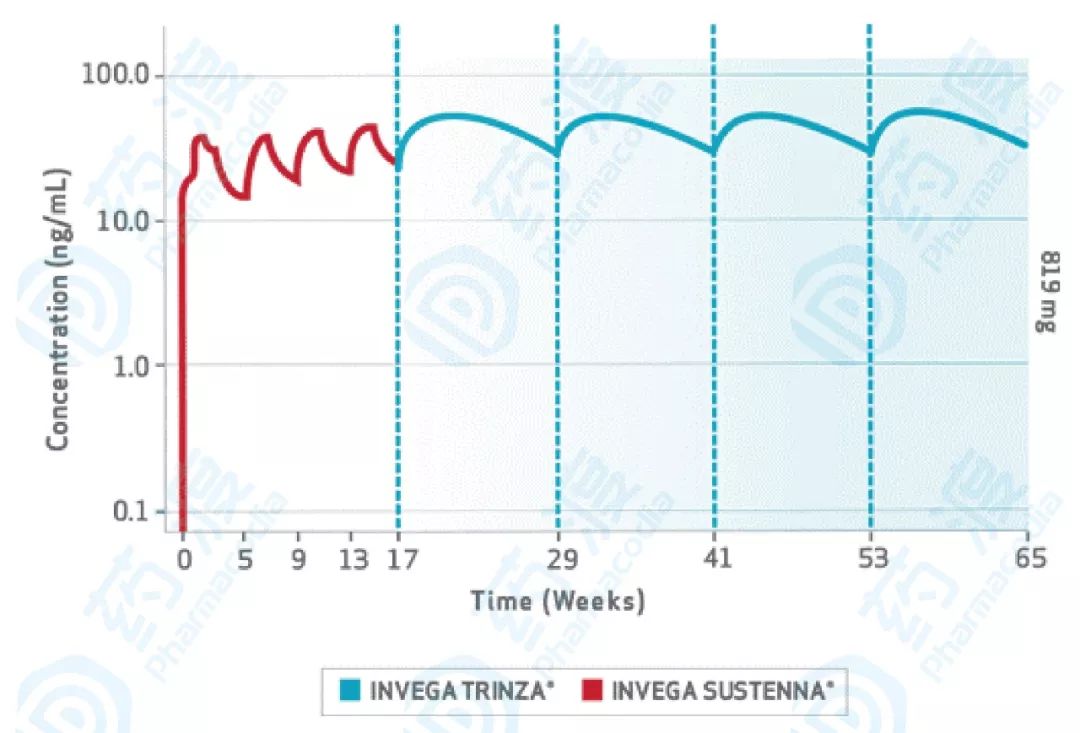
Invega Trinza(3个月剂型)的血药浓度曲线如下图10,由于两种产品(INVEGATRINZA ? 和INVEGA SUSTENNA ? )之间的中位药代动力学曲线不同,在直接比较它们的药代动力学特性时应谨慎 [8] 。
图10.棕榈酸帕利哌酮血药浓度图
在关键试验(PSY-3012)的双盲阶段,PP3M在延缓已经经过29周OpenLabel治疗期间获得满意症状控制的受试者**分裂症症状的复发方面优于安慰剂。基于第42次复发事件后进行的预先计划的中期分析,两个治疗组在**分裂症症状复发的时间上有统计学意义的差异,有利于PP3M。安慰剂组(23%)中经历复发事件的受试者是PP3M组(7%)的三倍。因此,试验按照统计分析计划中预先规定的提前终止。此外,PP3M的安全性似乎与帕利培酮棕榈酸酯(PP1M)1个月INVEGA SUSTENNA的安全性基本一致。具体结果如下图11所示。
图11.棕榈酸帕利哌酮注射液(3个月)中期分析结果图[9]
![图11.棕榈酸帕利哌酮注射液(3个月)中期分析结果图[9]](https://cimg.cphi.cn/img_Cphi_cn/news/2019_12/Mimg_1912260150506764.jpg)
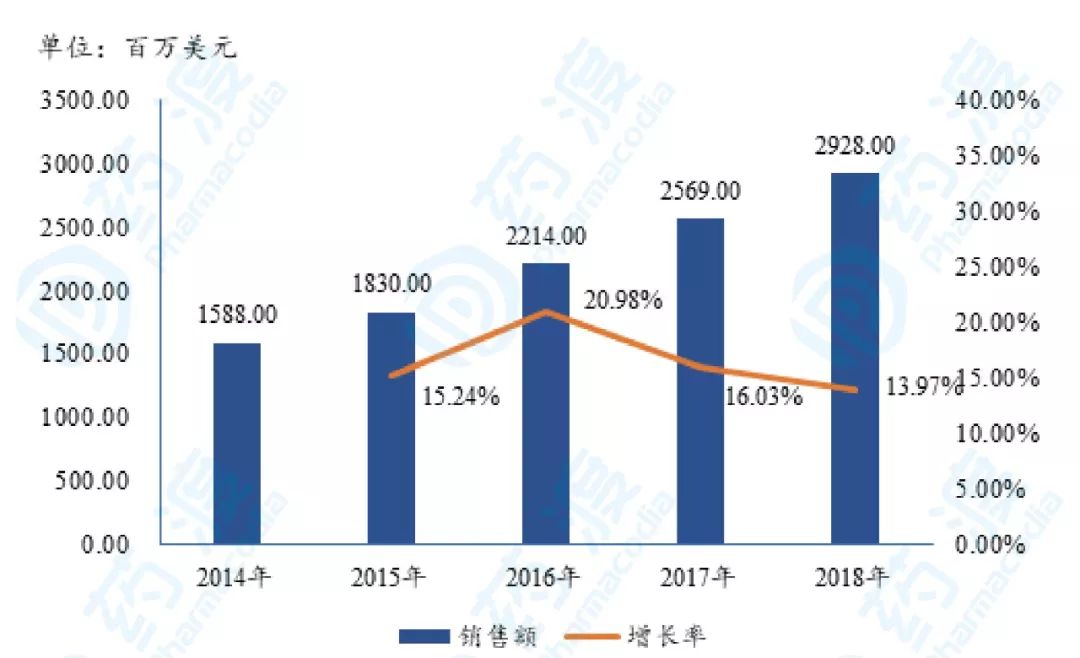
棕榈酸帕利哌酮1月和3月间隔周期注射剂销售额如下图12所示 [10] 。
图12.Invega Trinza和Invega Sustenna销售趋势图
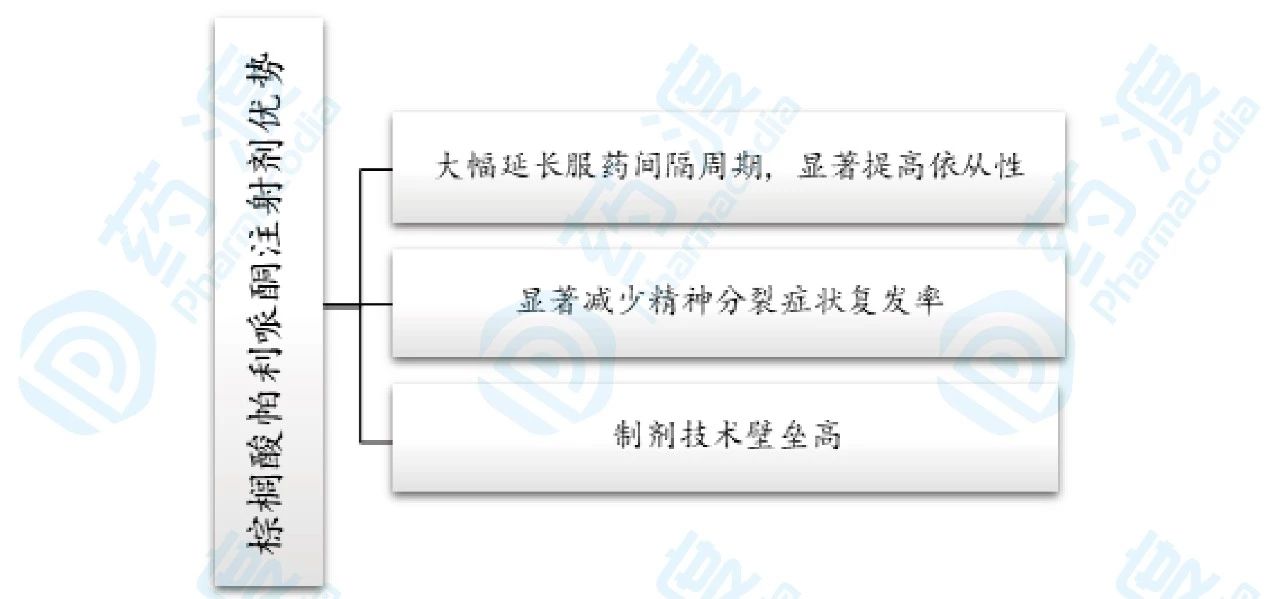
棕榈酸帕利哌酮注射剂优势总结图如下图13所示。
图13.棕榈酸帕利哌酮长效注射剂优势总结图
五、利培酮改良第五春
棕榈酸帕利哌酮长效注射剂的风头正盛,利培酮的改良之路似乎圆满落幕,但Indivior Inc并不满足于此,它想为**病患者带来新的选择,它的开发重点重新落在了利培酮本身,强生利培酮注射微球2周注射一次,它采用缓控释技术获得了更大的突破。2018年7月27日,利培酮一个月注射一次的长效皮下注射剂获批上市。
Indivior Inc利培酮长效注射剂(Perseris Kit)使用无菌双注射器混合系统提供。一个注射器预先填充液体输送系统,该液体输送系统由可生物降解的DL-丙交酯-乙交酯共聚物(丙交酯与乙交酯的摩尔比为80:20)溶解在N-甲基-2-吡咯烷酮中,N-甲基-2-吡咯烷酮是一种水溶性、生物相容性溶剂;该输送系统也称为ATRIGEL输送系统。第二注射器预先填充利培酮粉。一旦通过混合2个注射器的内容物制备了利培酮注射剂,它就被注射到腹部的皮下。利培酮在聚合物溶液中溶解和悬浮。注射后,输送系统与体液接触后固化,所产生的可生物降解植入物在延长的一段时间内以受控的方式释放利培酮。这与微球型利培酮LAI系统形成对比,后者使用静态流动方法将利培酮整合到D,L-丙交酯-乙交酯共聚物基质中,在14天内降解(通过每月两次注射) [11][12] 。
注射后,与体液接触时形成SQ库。存在两个吸收峰,第一个吸收峰出现在注射后4-6小时,这是由于在SQ库凝固时利培酮的初始释放。由于从SQ仓库缓慢释放,第二个峰值出现在注射后10至14天。两个峰值具有相似的幅度。整合的人群药代动力学模型显示,体重指数(BMI)较小的患者具有较高的初始峰值,但BMI对第二峰值没有影响。利培酮的活性代谢物9HR也有两个吸收峰:第一个峰出现在注射后4-48小时,第二个峰出现在注射后7-11天 [13][14] 。
Perseris Kit的优势可以用下图14来总结。
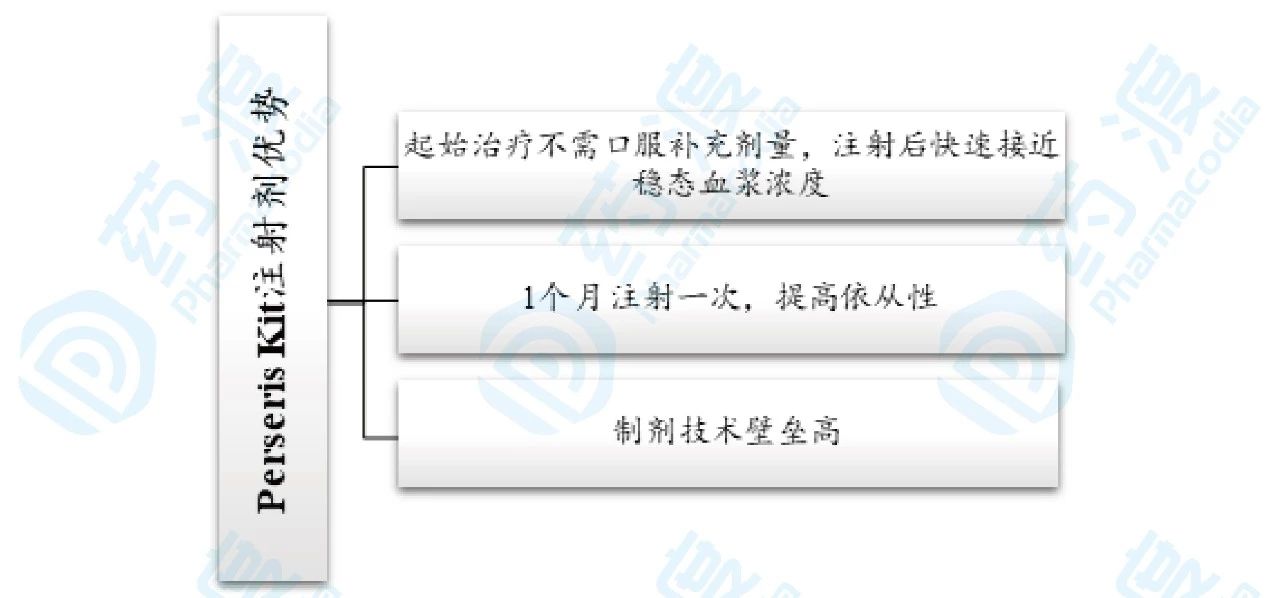
图14.Perseris Kit长效注射剂优势总结图
六、 利培酮改良第六春
Emily A Carlson[15]等研究结果表明,17β-羟基类固醇脱氢酶型(HSD10)的过表达加速了嗜铬细胞瘤细胞的生长,增强了细胞的呼吸,并增加了细胞对细胞死亡诱导的抵抗力。这表明阻断HSD10可以阻止和/或防止癌症的生长,从而为癌症患者提供了一个有希望的新靶点作为一种筛查或治疗选择。
Suzanne J Dilly [16] 等酶抑制研究结合计算模型表明,在研究的抗**病药和相关药物中,利培酮是体外最好的全长人17β-羟基类固醇脱氢酶型抑制剂,预测结合模型如下图15,左图利培酮(青色)、RM-532-46(绿色)和NAD辅助因子(橙色)的覆盖,模拟HSD10的活性位点(PDB-ID:1U7T),当没有NAD辅助因子存在时,预测利培酮结合效果最好,这意味着是一种竞争性结合模式。利培酮与瘤胃酸的配方创造了一种新药VAL401。VAL401在体外降低PC3前列腺癌细胞的活性,并延长体内PC3前列腺癌异种移植小鼠的寿命。VAL401有望作为前列腺癌和其他腺癌的药物进行临床试验。
利培酮的又一个春天来了,目前VAL401已经完成了针对非小细胞肺癌的二期临床试验,最新公布的VAL401药代动力学显示与从常规配方的利培酮发表的数据中获得的相应参数相比,VAL401体内的生物学过程发生了改变。获得的绝对值为VAL401作为癌症治疗的未来研究提供了支持,因为Cmax显示了足够的暴露以达到临床前抗癌试验期间观察到的浓度,活性部分的总体暴露支持在未来的临床试验中使用来自常规利培酮的安全性和耐受性数据 [17] 。
他山之石 可以攻玉
利培酮的505(b)(2)改良之路从1993年末开始至今已有26年,改良的步伐从未停止,全新的分子结构固然吸睛无数,但老药改良未尝不是一个好的选择。总结利培酮的改良开发成功经验,不难看出合理选择药物品种和围绕品种选择合理立项开发方向的重要性。产品的成功与技术的可行性、知识产权的保护、商业价值的预测、改良相关法规的深刻理解有着密切的关系。国内2类新药注册分类与505(b)(2)分类有着很大的相似性,利培酮的改良之路或许可以为国内2类改良药物的开发立项提供很好的思路。
一部利培酮改良史将医药人进行505(b)(2)品种开发的智慧演绎到极致。利培酮已经经历了第N春,国内2类新药的春天何时会来?还是已经到来?



合作咨询
![]() 肖女士
肖女士
![]() 021-33392297
021-33392297
![]() Kelly.Xiao@imsinoexpo.com
Kelly.Xiao@imsinoexpo.com
 2006-2025 上海博华国际展览有限公司版权所有(保留一切权利)
沪ICP备05034851号-57
2006-2025 上海博华国际展览有限公司版权所有(保留一切权利)
沪ICP备05034851号-57