FDA药审动态
本周(1月10日-1月19日),FDA消息频传,索马鲁肽获批新适应症;专家组以罕见的27:0全票反对Nektar的mu-阿 片受体激动剂NKTR-181的上市申请,挚盟医药抗乙肝病毒核衣壳抑制剂获临床试验许可等等,还有两个重磅药品组合疗法的优先审评...
奥拉帕利组合疗法获优先审评资格
阿斯利康/默沙东的奥拉帕利(olaparib,Lynparza)的补充新药申请已获FDA受理,并获授予优先审评资格,联合贝伐珠单抗(bevacizumab),用于对含铂化疗药完全或部分应答的晚期卵巢癌患者的一线维持治疗。
若获批,这将是Lynparza在美国获批治疗卵巢癌的第4个适应症。
Opdivo+Yervoy一线治疗非小细胞肺癌上市申请获FDA优先审评资格
Opdivo和Yervoy是BMS开发的免疫检查点抑制剂。Opdivo是一款抗PD-1单克隆抗体,而Yervoy是一款抗CTLA-4单克隆抗体。这一双重检查点抑制剂组合疗法已经获得FDA批准,一线治疗具有中度和高度风险的晚期肾细胞癌患者,以及经治MSI-H/dMMR转移性结直肠癌患者。
美国FDA已经接受了Opdivo (nivolumab)与Yervoy (ipilimumab)联合疗法的补充生物制剂上市申请(sBLA) ,用于一线治疗无EGFR或ALK基因突变的转移性或复发性非小细胞肺癌(NSCLC)患者。美国FDA同时授予该申请优先审评资格。
NMPA审批新动态
本周CDE12个报生产受理号(7个品种)审评审批办理状态更新;其中5个品种状态呈“已发件”、5个品种“制证完毕-待发批件”、2个品种“在审批”状态,具体内容见下表:
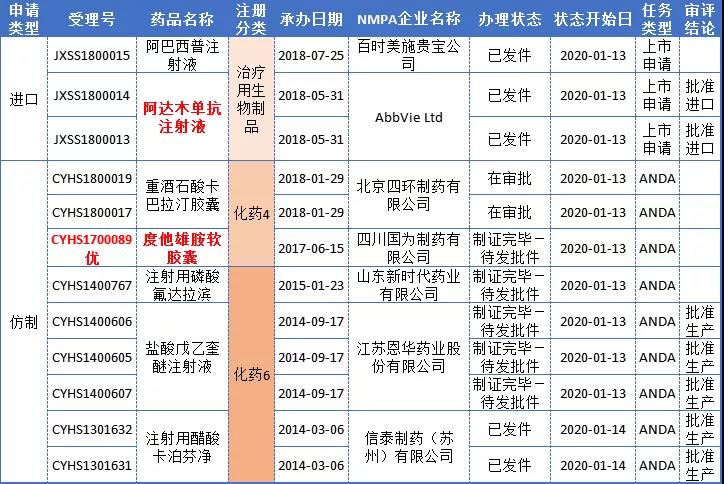
国为制药泌尿系统领域再突破,拿下重磅首仿!
度他雄胺(Dutasteride)由葛兰素史克研发,通过阻断5-α还原酶,将睾酮转化为双氢睾酮(DHT)。适用于治疗良性前列腺增生(BPH)并改善前列腺肥大症状,减少急性尿潴留的风险,并降低BPH相关手术风险。与α-肾上腺素能拮抗剂-坦索洛新联合,用于男性前列腺肥大的前列腺增生症的治疗。
药智数据显示,该品种国内仅有原研获批上市,目前国内有12家企业布局度他雄胺软胶囊,其中仅3家企业申报上市,不出意外,顺利获批,四川国为制药将拿下首仿,向原研发起冲击(详见下表)。
度他雄胺胶囊药品注册详情
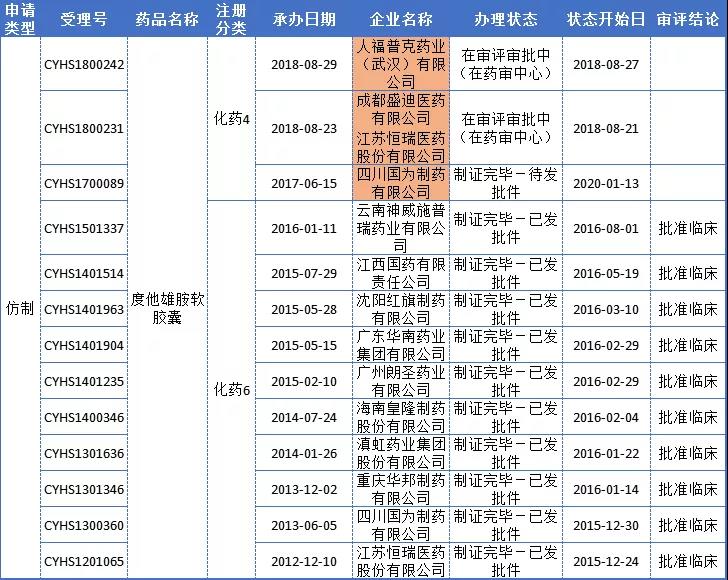
此外,值得提及的是,1月17日轰轰烈烈的全国第二批药品集中带量采购在上海开展,四川国为制药与度他雄胺同为泌尿系统药物的琥珀酸索利那新片,且同是四川国为制药的首仿药,以29.89元的价格成功入选,如若本周四川国为制药与度他雄胺软胶囊获批,再拿一首仿,将丰富其公司在该治疗领域的治疗药物产品线,同时拓展拓宽市场份额。
进军胃肠病领域!修美乐第5个适应症在华获批
修美乐于2010年在中国上市,目前已获批5个适应症:2010年获批类风湿关节炎适应症;2013年获批强直性脊柱。
适应症;2017年获批中重度斑块状银屑病适应症;2019年获批多关节型幼年特发性关节炎适应症;2020年修美乐获批中重度活动性成人克罗恩病适应症。
修美乐是目前中国首个可以用于治疗克罗恩病的全人源抗肿瘤坏死因子(TNFi)单克隆抗体,此次获批也意味着修美乐进入了一个全新的治疗领域——胃肠病领域。
价格高、适应症少、仿制品的冲击都限制了修美乐在中国市场的渗透率,药智数据显示目前已获批上市的国产阿达木单抗有2家,另外有三家已经提交上市申请。
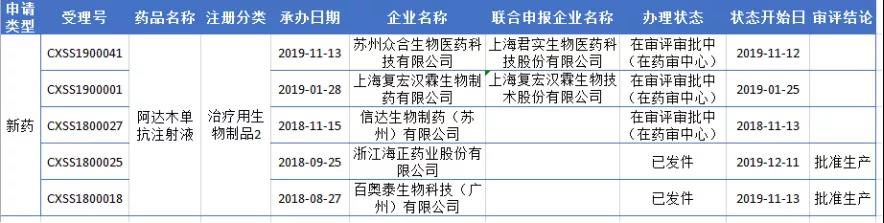
原研市场受到三重夹击的状态下,艾伯维选择以1290元/支(价格下降83%)进入2019国家医保目录,实现快速放量。此次获批新适应症,意在快速抢占中国市场,增加竞争优势。相信未来,修美乐会有更多适应症在中国获批上市。
CDE审评审批新受理
本周CDE新增报生产受理号42个,涉及22个品种;具体内容如下:
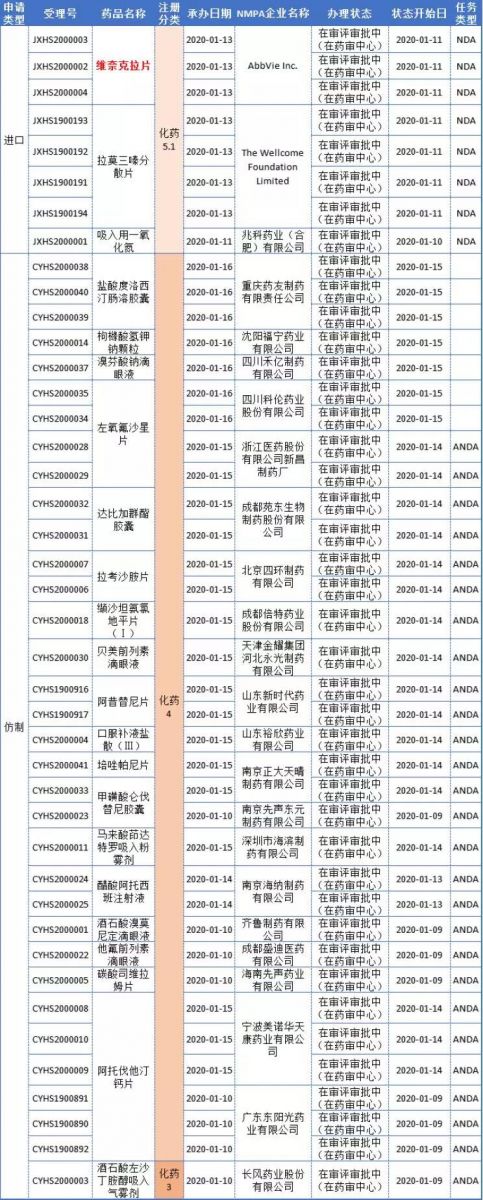
全球首个Bcl-2抑制剂——维奈克拉3项上市申请获受理
Bcl-2在细胞凋亡中发挥重要作用,是血液癌症治疗的一个新靶标。维奈克拉(venetoclax)由艾伯维/罗氏旗下基因泰克联合开发,是一款全球首创的口服、选择性B细胞淋巴瘤因子-2(BCL-2)抑制剂。
维奈克拉最早在2016年4月11日获得FDA批准,是FDA批准的首个针对Bcl-2的药物,用于治疗白血病。曾获FDA授予多项突破性疗法认定。
该药物拟用于治疗多发性骨髓瘤(MM)的临床申请一周前已获得国家药监局临床批准。
数据显示,在中国,该药物目前仍有3项临床正在开展中,适应症分别为急性髓系白血病、初治急性髓系白血病以及伴17p缺失的复发性或难治性慢性淋巴细胞白血病。




合作咨询
![]() 肖女士
肖女士
![]() 021-33392297
021-33392297
![]() Kelly.Xiao@imsinoexpo.com
Kelly.Xiao@imsinoexpo.com
 2006-2025 上海博华国际展览有限公司版权所有(保留一切权利)
沪ICP备05034851号-57
2006-2025 上海博华国际展览有限公司版权所有(保留一切权利)
沪ICP备05034851号-57