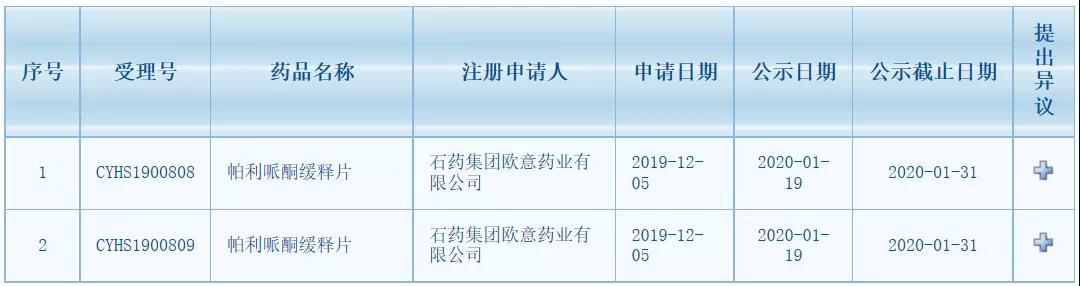
1月19日,CDE 公布了新一批拟纳入优先审评审批名单,其中包括石药集团欧意药业帕利哌酮缓释片的上市申请(受理号CYHS1900808/09)。
帕利哌酮缓释片由强生子公司西安杨森开发,于2006年12月20日获得美国FDA批准,用于治疗**分裂症,是2003年以来FDA批准的首个治疗**分裂症的处方药。在中国,帕利哌酮缓释片于2008年获批,用于治疗**分裂症成人患者,随后于2017年获批用于治疗青少年(12-17岁,体重≥29 kg)**分裂症患者。截至目前,帕利哌酮缓释片已在全球一百多个国家/地区获批上市,用于治疗**分裂症,并在50多个国家/地区获批用于治疗青少年**分裂症患者。
作为一种非典型性抗**病药,帕利哌酮其实是利培酮的改良成果。利培酮也是由强生研发的,其口服片剂于1993年12月在美国获批上市,商品名为Risperidal?。在开发过程中,发现利培酮的体内代谢物9-羟利培酮也具有一定的药理活性,强生就开始针对9-羟利培酮进行研究,从而产生了帕利哌酮缓释片。
不过强生并未满足于此,其与EDT公司合作,利用纳米晶体技术开发了棕榈酸帕利哌酮注射剂。2009年7月31日,Invega Sustenna(paliperidone palmitate,棕榈酸帕利哌酮缓释注射剂)获FDA批准上市,成为治疗**分裂症的首个每月一次的、非典型的、长效注射液。
六年后,2015年5月18日,Invega Sustenna的升级版Invega Trinza获FDA批准,用于**分裂症的治疗,后者每3个月肌肉注射一次,每年只需注射4次。Invega Trinza是目前全球首个也是唯一一个一年用药仅4次的**分裂症治疗药物。
目前国内帕利哌酮缓释片及棕榈酸帕利哌酮缓释注射剂仅有进口原研产品,不过距离首仿获批也不远了。2019年3月19日,江苏豪森药业帕利哌酮缓释片的上市申请获得CDE承办(受理号CYHS1900200/21),2019年12月3日,石药集团欧意药业帕利哌酮缓释片的上市申请获得CDE承办。虽然从申报时间上来说,豪森药业略早于石药欧意,但是若此次石药成功进入优先审评名单,未来谁将拿下帕利哌酮缓释片首仿还真不好说。最终胜负属谁,我们静待佳音。
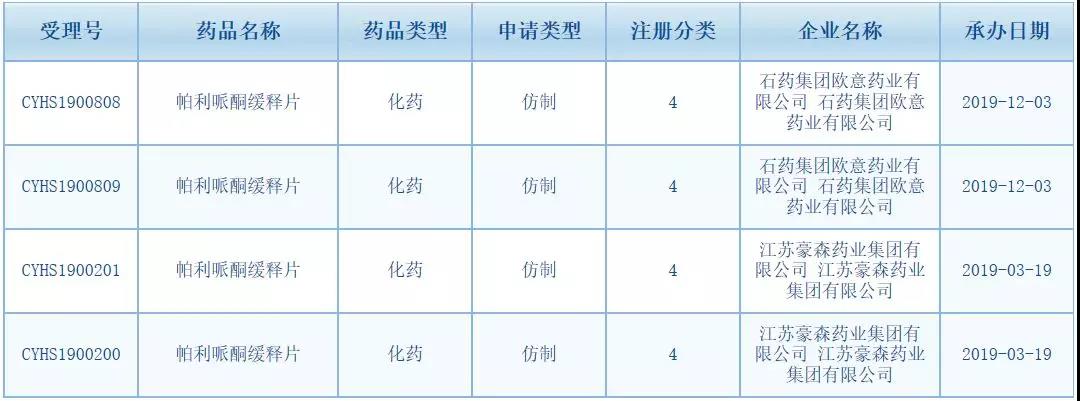
相关资料显示,除了豪森、石药已报产,国内还有科伦药业、连云港宏创药业、齐鲁制药、京新药业等企业的帕利哌酮缓释片已经获批临床。



合作咨询
![]() 肖女士
肖女士
![]() 021-33392297
021-33392297
![]() Kelly.Xiao@imsinoexpo.com
Kelly.Xiao@imsinoexpo.com
 2006-2025 上海博华国际展览有限公司版权所有(保留一切权利)
沪ICP备05034851号-57
2006-2025 上海博华国际展览有限公司版权所有(保留一切权利)
沪ICP备05034851号-57