CFDA先后在2016年2月26日和2017年12月28日发布了《总局关于解决药品注册申请积压实行优先审评审批的意见》(食药监药化管〔2016〕19号)和《总局关于鼓励药品创新实行优先审评审批的意见》(食药监药化管〔2017〕126号)的公告,标志着“优先审评”制度从以解决积压注册申请为主,开始转向加快具有临床价值的新药和临床急需仿制药的研发上市。
对于被纳入优先审评的药物来说,有机会尽早进入临床或上市。2019年共有123个未在中国上市药品被纳入国家药品审评中心的优先审评审批,审评类型包括新药上市、进口上市和临床申请。
纳入优先审评的化药
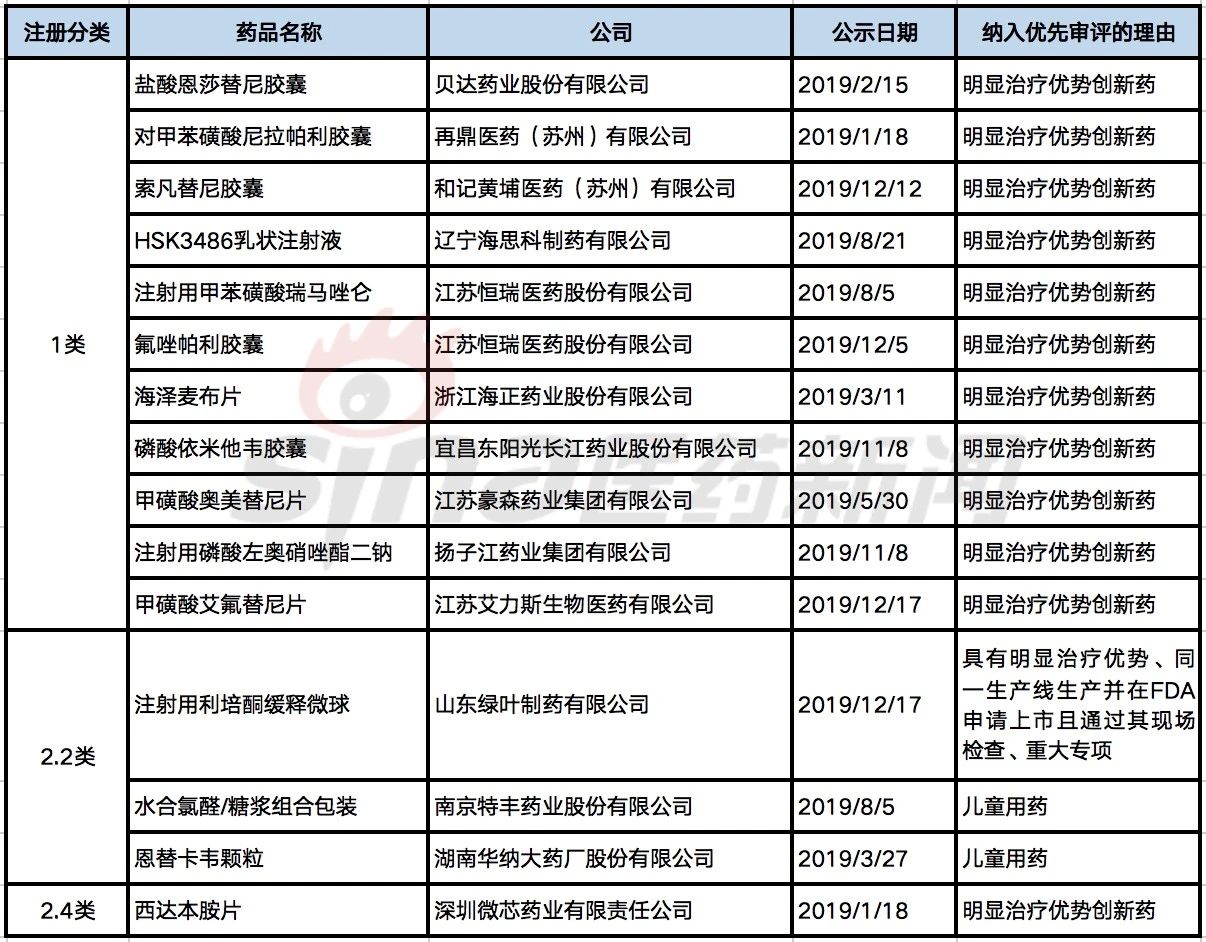
从药品类型来看,未在中国上市在2019年被纳入优先审评的药品,以化药为主,在69个仿制药中,3类:境内申请人仿制境外上市但境内未上市原研药品的药品有25个;4类:境内申请人仿制已在境内上市原研药品的药品有44个。
14个在2019年被纳入优先审评的化药新药中,1类:境内外均未上市的创新药有10个;2类:境内外均未上市的改良型新药有4个。
在2019年被纳入优先审评且在同年获批的化药新药有两个,一是对甲苯磺酸尼拉帕利,从2019-01-18公示纳入优先审评至2019-12-27获批上市,历时11个月,适应症为对含铂化疗完全或部分缓解的复发性上皮性卵巢癌、输卵管癌或原发性腹膜卵巢癌成人患者维持治疗;二是西达本胺新增适应症——治疗激素受体阳性、人表皮生长因子受体-2阴性、绝经后、经内分泌治疗复发或进展的局部晚期或转移性乳腺癌患者,从2019-01-18至2019-11-29,历时10个月。
表1 2019年上市申请纳入优先审评的化药新药
13个进口化药在2019年被纳入优先审评,其中5.1类境外上市的原研药约占70%。
诺华的西尼莫德片是2019年唯一被纳入优先审评的进口1类境内外均未上市的创新药,是仅次于芬戈莫德第二个鞘氨醇-1-磷酸受体(Sphingosine-1-phosphate receptor,SIPR)调节剂,首款用于治疗继发进展型多发性硬化症的上市药物,在中国的进口上市申请于2019年2月18日获受理,早于在2019年3月26日获得美国FDA批准上市,2019年5月作为治疗罕见病药物而被纳入优先审评通道。
表2 2019年进口申请纳入优先审评的化药新药

纳入优先审评的生物药
2个治疗用生物制品新药在2019年被纳入优先审评。
泰它西普是一款用于治疗红斑狼疮的TACI-Fc融合蛋白,具有全新的药物结构和双靶点作用机制,能同时抑制BLyS和APRIL两个B淋巴细胞分化成熟的细胞因子,这两个因子的过度表达是系统性红斑狼疮等多种B淋巴细胞相关的自身免疫疾病的重要原因。泰它西普从11月13日上市申请获CDE承办到拟纳入优先审评仅历时23天。
重组人纽兰格林(rhNRG-1,Neucardin®)是用于治疗轻、中度慢性心力衰竭的First-in-Class基因工程生物新药。上市申请在2019年2月1日获得CED承办后约1个月被纳入优先审评,而在2020年2月12日因现有研究数据不足而未获国家局批准,需开展一项以心功能为主要疗效指标的临床研究,且补充药学、药理毒理数据,以支持有条件批准上市。
表3 2019年纳入优先审评的生物制品新药和生物类似药

6个生物类似药的上市申请被纳入优先审评,其中阿达木单抗生物类似药市场竞争将加剧,申报企业有3家:除了已获批上市的海正药业,还有信达生物和复宏汉霖,信达生物的利妥昔单抗和贝伐珠单抗生物类似药也纳入了优先审评,复宏汉霖有望夺得首个获批上市的曲妥珠单抗生物类似药。
获上市申请优先审评最多的企业
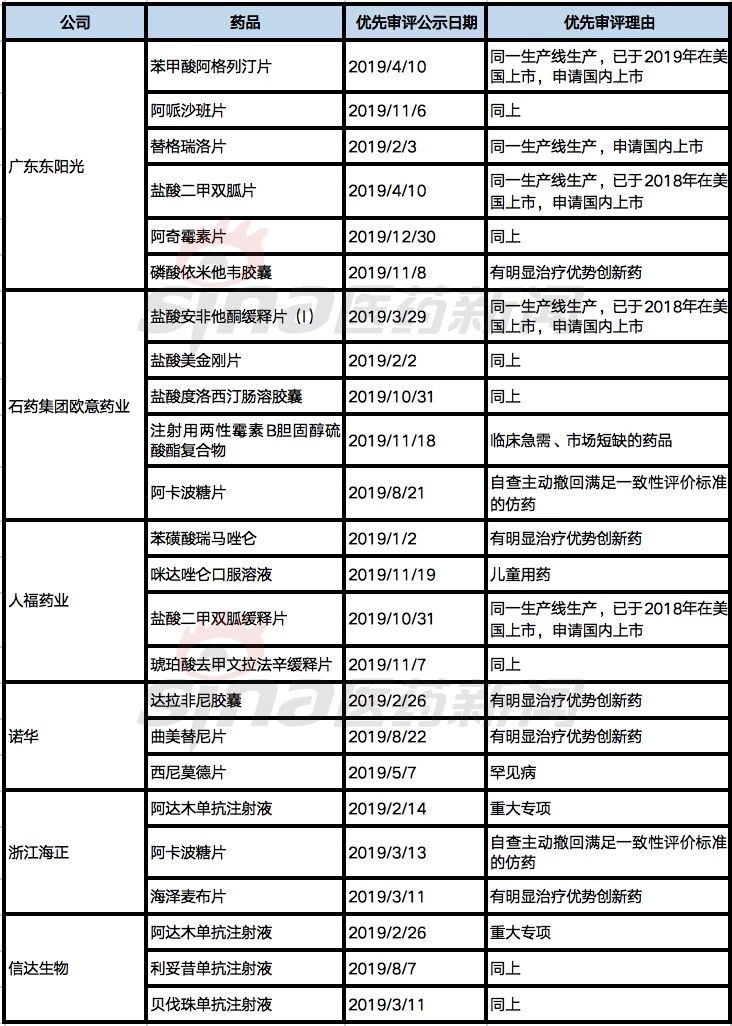
广东东阳光、石药欧意、人福药业、诺华、海正药业、信达生物是2019年获得上市申请优先审评最多的企业,多数药品均仍处于在审评状态。
广东东阳光(统计包括宜昌东阳光)、石药欧意、人福药业除创新药外,还有儿童药、美国上市同步申请国内上市、临床急需药品的布局,使得在国家鼓励政策下获优先审评资格最多,新药和仿药均将进入收获期。信达生物3个生物类似药上市申请获得优先审评,也将会进一步巩固其生物类似药第一梯队的位置。
表4 2019年中国未上市药品获优先审评最多的企业
数据来源:
1、Pharmadigger数据库
2、国家药品审评中心“优先审评公示”



合作咨询
![]() 肖女士
肖女士
![]() 021-33392297
021-33392297
![]() Kelly.Xiao@imsinoexpo.com
Kelly.Xiao@imsinoexpo.com
 2006-2025 上海博华国际展览有限公司版权所有(保留一切权利)
沪ICP备05034851号-57
2006-2025 上海博华国际展览有限公司版权所有(保留一切权利)
沪ICP备05034851号-57