3月23日,复宏汉霖公布其2019年业绩,2019全年营收约9090万元,主要来自其唯一上市产品--汉利康(约7900万),而研发支出约14.07亿元,较2018年增长44.66%。

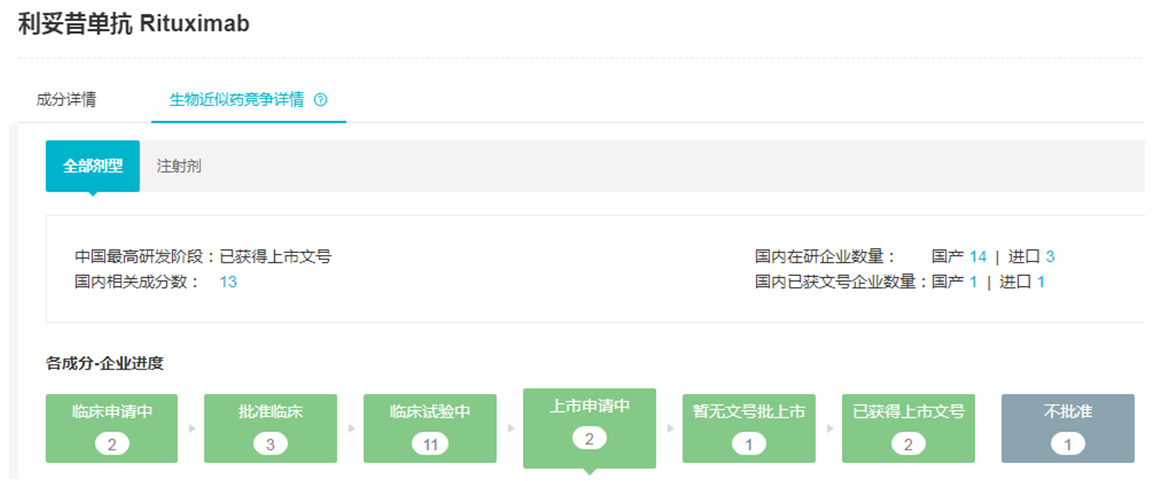
汉利康(利妥昔单抗注射液)是国内首个获批的生物类似物,于2019年2月被NMPA批准,用于治疗复发或耐药的滤泡性中央型淋巴瘤、D20阳性III-IV期滤泡性非霍奇金淋巴瘤和CD20阳性弥漫大B细胞性非霍奇金淋巴瘤,2019年5月正式在国内上市销售。
据insight数据库,目前汉利康在国内上市销售的规格只有一种,即100mg,在不同地区的价格为1398/1640/1648元,而其原研药--罗氏美罗华有两个规格100mg和500mg,其中100mg在多地的价格为2294元,500mg价格为7866元以上。不过汉利康由复宏汉霖生产,控股股东复星医药附属公司江苏复星负责销售,两家平分汉利康在国内销售所得的所有净利润,按汉利康给复宏汉霖带来的收入,预计汉利康2019年销售额应该破亿。而且复宏汉霖还在开发汉利康用于治疗类风湿性关节炎,目前正在进行3期临床试验。笔者预计未来汉利康有望凭借价格优势以及适应症的扩大,进一步冲击美罗华在国内的市场,
不过据insight数据库,目前国内还有十多家企业布局利妥昔单抗市场,其中百济神州的利珀妥单抗和信达生物的利妥昔单抗-IBI301已递交上市申请,而正大天晴、华兰基因工程、喜康生物、嘉和生物/南京优科、上海生物制品研究所和浙江海正几家企业处于3期临床试验阶段。
而且,近日我国CDE官网发布了关于公开征求《利妥昔单抗注射液生物类似药临床试验指导原则》意见的通知,这意味着国内首部针对利妥昔单抗注射液生物类似药的临床试验指导原则有望正式问世,弥补我国对利妥昔单抗注射液生物类似药临床试验在法规层面和技术层面的缺失。
此外,复宏汉霖还有两款生物类似物处于上市申请阶段,即曲妥珠单抗(HLX02)和阿达木单抗(HLX03),目前这两款产品的上市申请均已被CDE受理,且被纳入优先审评范围,预计有望今年获批。值得一提的是,曲妥珠单抗的上市申请也于去年6月被欧盟受理,成为首个获欧盟受理的中国籍生物类似物。而且,复宏汉霖也正在筹备向国家药监局递交另外一款生物类似物--贝伐珠单抗(HLX04)的新药申请。
复宏汉霖还有一些处于早期研究阶段的生物类似物,比如西妥昔单抗(HLX05)、帕妥珠单抗(HLX11)、雷莫芦丁单抗(HLX12)、伊匹木单抗(HLX13)和地舒单抗(HLX14),其中HLX05作用于EGFR靶点,已获得治疗转移性结直肠癌和头颈癌的临床试验批件;HLX11作用于HER2靶点,可与曲妥珠单抗和化疗联合用于HER2阳性乳腺癌的辅助治疗、新辅助治疗以及HER2阳性转移性乳腺癌的治疗;HLX12作用于VEGFR2靶点,可用于胃癌或胃食管结合部腺癌、转移性非小细胞肺癌及转移性结直肠癌等实体瘤的治疗,已在国内启动1期临床试验;HLX13作用于CTLA-4靶点,有望用于黑色素瘤、肾细胞癌和结直肠癌的治疗,目前在国内申请临床试验;HLX14作用于RANKL靶点,有望开发用于治疗女性绝经后的骨质疏松症,也处于临床试验申请阶段。
除了布局生物类似物市场,复宏汉霖同时也聚焦创新生物药和肿瘤联合疗法的开发,例如针对VEGFR靶点的HLX06、针对EGFR靶点的HLX07、针对PD-1的HLX10、针对PD-L1的HLX20、针对HER22的HLX22和针对c-MET的HLX55。
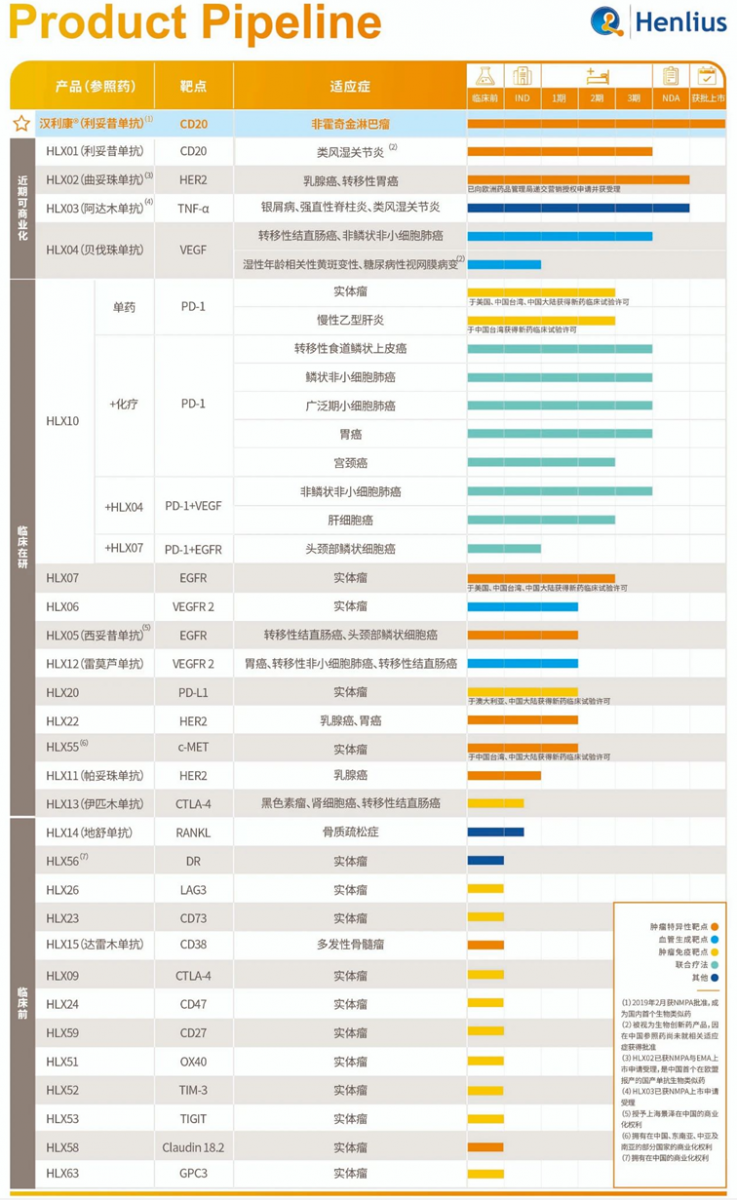
其中HLX06是一款创新型重组抗VEGFR2全人单克隆抗体,可广泛用于实体瘤的治疗,已获得美国、中国台湾和中国大陆的临床试验批准,正在中国台湾开展1期临床试验;HLX07是一款改良创新型重组抗EGFR人源化单克隆抗体,可广泛用于实体瘤的治疗,目前该产品已相继获得中国台湾、中国大陆及美国的临床试验批准,正在内地开展1b/2期临床试验;HLX10是其自主研发的一款创新型抗PD-1单抗,目前已相继获得美国、中国台湾和中国大陆的临床试验批准,并针对MSI-H/dMMR(高度微卫星不稳定性/错配修复缺陷)实体瘤和慢性乙型肝炎开展单药2期临床研究,预计有望凭借2期研究于2020年底/2021年初申报上市;HLX20是一款重组抗PD-L1全人单克隆体,可联合其他产品开展肿瘤免疫疗法,广泛用于实体瘤的治疗,目前也已相继获得澳大利亚、中国的临床试验批准,正在澳大利亚开展1期临床试验。
而HLX22和HLX55不同于上述几款药物,是来自其他公司受让、并后续自主研发的创新型单克隆抗体项目,其中HLX22已获得国家药监局临床试验批准,未来可用于胃癌和乳腺癌等实体瘤的治疗,目前其1期临床试验已在国内完成首例患者给药,而HLX55是一款靶向HGF/c-MET(天然配体肝细胞生长因子/c-MET)信号通路的人源化单克隆抗体,已在中国大陆及中国台湾获得临床试验许可,其用于对标准治疗耐药的晚期实体瘤患者的1期临床研究已在中国台湾完成首例患者给药。
值得一提的是,目前全球还未有针对c-MET靶点的特异性药物获批上市,HLX55有望成为同类首款抗c-MET单抗。据悉,HLX55除了可以高效特异阻断c-MET与配体的结合之外,还可以同时诱导c-MET内吞和降解,预计通过这样的双重作用机制,HLX55有望在临床中展现出更强的抗肿瘤作用效果。
除了积极推进单药的临床开发,复宏汉霖还全面开启"Combo+Global"(联合治疗+国际化)差异化战略,以HLX10为核心,联合其他药物,在全球范围内启动多项临床试验,探索食管鳞癌、肺癌、肝癌、胃癌、宫颈癌及头颈鳞癌等多种实体瘤的治疗。其中HLX10+HLX04、HLX10+HLX07的联合疗法已先后获国家药监局临床试验批准,HLX10+HLX04联合疗法正在国内开展2/3期临床试验。
而且,为了推进国际化布局,除了设在上海、台北和美国加州的三个研发中心密切合作,复宏汉霖还与其他国际制药企业达成战略商业化合作,例如2019年6月,携手Accord成功向欧盟递交了针对HLX02(注射用曲妥珠单抗)的营销授权申请并获受理,顺利向前推进HLX02闯关欧盟的进程。2019年9月,复宏汉霖与KG Bio达成合作共识,授予KG Bio在东南亚10个国家对HLX10(抗PD-1单抗)的若干适应症和联合疗法的独家开发与商业化权利。
在生产方面,复宏汉霖按照国际质量标准建立生物药生产基地以提高产能,且针对产品开发周期设定阶段性产能规划,基于已建立的质量管理体系,逐步提升和完善大规模生产能力,达到成本经济效益,有效降低生产成本。在销售方面,复宏汉霖不断完善公司整体商业规划及产品市场策略,建立起全方位的创新商业运营模式,不仅建立起自主商业化团队,负责公司主导的核心肿瘤产品的商业化推广,包括将陆续实现商业化的HLX02、HLX04、HLX07和HLX10等多个重磅肿瘤品种,同时还积极借助合作伙伴在不同产品领域的既有经验助力产品商业化推广。
参考资料:
[1]复宏汉霖官网
[2]insight数据库
点击下图进行CPhI & P-MEC China 2020观众预登记抽奖,奖品多多!



合作咨询
![]() 肖女士
肖女士
![]() 021-33392297
021-33392297
![]() Kelly.Xiao@imsinoexpo.com
Kelly.Xiao@imsinoexpo.com
 2006-2025 上海博华国际展览有限公司版权所有(保留一切权利)
沪ICP备05034851号-57
2006-2025 上海博华国际展览有限公司版权所有(保留一切权利)
沪ICP备05034851号-57