精彩内容
4月1日,CDE官网显示,东阳光药盐酸芬戈莫德胶囊拟纳入优先审评,纳入理由为“同一生产线生产,已于2019年在美国上市,申请国内上市”。盐酸芬戈莫德胶囊为第一批临床急需境外新药。纳入优先审评后,东阳光药将加速拿下盐酸芬戈莫德胶囊国内首仿。
拟纳入优先审评公示

芬戈莫德是一种新型免疫抑制剂,属于神经鞘氨醇1-磷酸受体调节剂,能促使淋巴细胞在淋巴结中滞留,达到抑制自身免疫反应的效果。2018年11月1日CDE发布第一批临床急需境外新药名单,芬戈莫德被列入。
芬戈莫德原研药为诺华的捷灵亚,2010年9月21日获FDA批准上市,是全球首个获批治疗多发性硬化症的口服药物。该药于2019年4月申请国内上市,2019年7月12日获批生产。据诺华财报,2019年芬戈莫德全球销售额为32.23亿美元。
诺华芬戈莫德全球销售额情况(百万美元)
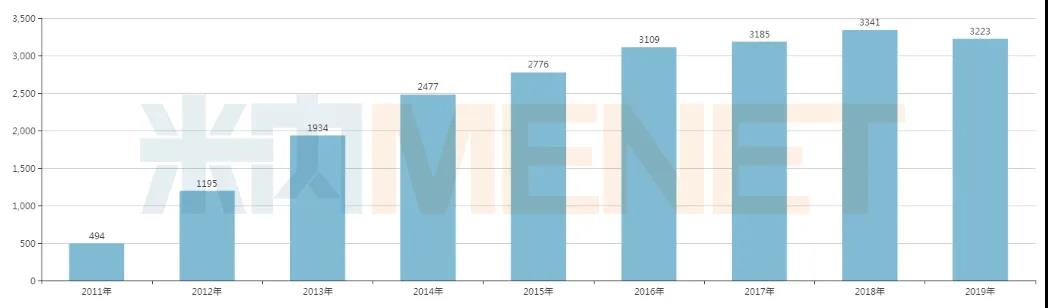
(点击图片可放大)
2019年12月4日,FDA批准东阳光药的盐酸芬戈莫德胶囊首仿上市,同时获批首仿的还有印度药企必奥康和太阳药业。2020年2月26日,东阳光药盐酸芬戈莫德胶囊的上市申请获CDE承办,成为该品种国内首家报产企业。纳入优先审评后,东阳光药拿下盐酸芬戈莫德胶囊国内首仿的日程将提速。



合作咨询
![]() 肖女士
肖女士
![]() 021-33392297
021-33392297
![]() Kelly.Xiao@imsinoexpo.com
Kelly.Xiao@imsinoexpo.com
 2006-2025 上海博华国际展览有限公司版权所有(保留一切权利)
沪ICP备05034851号-57
2006-2025 上海博华国际展览有限公司版权所有(保留一切权利)
沪ICP备05034851号-57