4月6日,生物制药公司Menlo Therapeutics宣布了两项评估每天一次口服药物serlopitant治疗结节性瘙痒(PN)相关瘙痒症的3期临床试验MTI-105和MTI-106的主要成果,两项研究均未达到各自的主要终点。该公司股价下跌约48%。
引起抓挠冲动的两个关键介质是物质P(SP)及其受体神经激肽1受体(NK1-R)。SP是一种天然肽,属于神经肽家族中的速激肽,后者在神经和免疫系统中具有广泛的功能。SP与NK1-R的结合已被证明是感觉神经信号传导的关键介体,涉及包括瘙痒反射和呕吐反射。
Serlopitant是一种小分子、高度选择性的NK1-R受体拮抗剂。此前临床试验显示其用于治疗尿失禁和膀胱过度活动症优于安慰剂,但与现有的批准药物相比没有优势,因此未针对该适应症进一步开发。
据悉,研究MTI-105和MTI-106(NCT03546816和NCT03677401)是两项设计相同的多中心、安慰剂对照、双盲3期临床试验,用于评估serlopitant的安全性和有效性。MTI-105在美国招募了285位患者,MTI-106在德国、波兰和奥地利招募了295位患者。入组患者在入选前至少6个月经历过瘙痒症,且瘙痒的根本原因与PN直接相关。所有患者在筛查时均报告每日24小时最差瘙痒强度数字评定量表(WI-NRS)得分在7或更高;随机分组前两周的每周最低平均WI-NRS得分为6.5。患者以1:1随机接受serlopitant(5mg,每天一次)或安慰剂治疗,治疗比较时间为10周,并且有额外的治疗后安全性评估期。
临床主要终点为WI-NRS的4点改善应答分析需要显示,与安慰剂相比,接受serlopitant治疗的患者瘙痒有统计学意义的显著降低,但两项试验均未能达到。在MTI-105中,在第10周时,与基线相比,serlopitant组在WI-NRS上取得4点或更多改善(主要疗效终点)的患者比例为26.45%,安慰剂组为20.31%(p = 0.229)。在MTI-106中,在第10周, serlopitant组在WI-NRS上取得4点或更多改善(主要疗效终点)的患者比例为25.90%,安慰剂组为18.95%(p = 0.158)。主要终点的所有支持敏感性分析的结果均与两项研究的主要分析相当。
事实上,这已经不是serlopitant治疗瘙痒症临床研究的第一次失败了。2018年4月,Menlo 公布了评估serlopitant治疗成人和青少年特应性皮炎相关瘙痒的MTI-103(ATOMIK)2期临床研究数据,在所有时间点上,与安慰剂组相比,serlopitant药物治疗组的数据有明显优势,但无统计学差异。研究未达到主要或关键的二级疗效终点。
同年10月,Menlo还宣布了serlopitant治疗难治性慢性咳嗽患者的中期TUSSIX试验的主要结果,该药与安慰剂相比未能显示出益处。基于TUSSIX试验结果,放弃难治性慢性咳嗽适应症的进一步开发。至此,serlopitant此前宣布的所有研发项目均以失败告终。
2012年,Menlo从默沙东手中获得了Serlopitant的全球独家权利(日本除外)。日前,Menlo首席执行官David Domzalski承认,公司已经不打算进一步研究该药物。
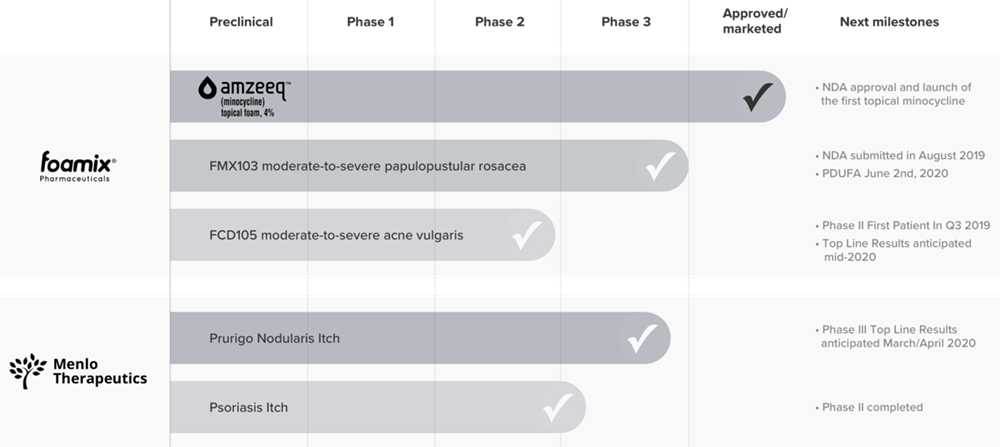
Menlo是一家开发和商业化专有疗法以解决皮肤病学未满足需求的生物制药公司,凭借在局部药物创新方面的专业知识作为跳板,努力利用其专有的分子稳定技术(MST?)开发各种药物并将其商业化。今年3月,该公司与Foamix Pharmaceuticals合并,后者现是Menlo的全资子公司,并带来了已上市的痤疮处方药AMZEEQ?。
今年1月,AMZEEQ?获得FDA批准,成为全球首个局部用抗生素米诺环素4%的外用泡沫剂型,该药用于治疗丘疹和红肿(非结节性炎症性病变),这种红肿通常在成人和9岁以上的儿童中会伴随中度至重度痤疮发生。
同时,Foamix还带来了米诺环素1.5%泡沫剂型的FMX103,用于治疗丘疹性酒渣鼻,目前正处于FDA监管审查阶段,PDUFA日期为2020年6月2日。如果获批,FMX103将是该公司2020年在美国上市的第二种药品。
此外,Foamix的另一款在研药物FCD 105已经进入2期临床阶段,有望在本季度晚些时候发布顶线数据。FCD 105是一种组合药物,含有米诺环素和类维生素A阿达帕林。
来自:公司官网
参考来源:
1、Menlo’s Serlopitant for Prurigo Nodularis Itching Flunks Two Phase III Trials
2、Menlo's serlopitant misses main goal in two Phase III studies of pruritus associated with prurigo nodularis
3、公司官网等



合作咨询
![]() 肖女士
肖女士
![]() 021-33392297
021-33392297
![]() Kelly.Xiao@imsinoexpo.com
Kelly.Xiao@imsinoexpo.com
 2006-2025 上海博华国际展览有限公司版权所有(保留一切权利)
沪ICP备05034851号-57
2006-2025 上海博华国际展览有限公司版权所有(保留一切权利)
沪ICP备05034851号-57