2020年3月12日,ICER发表了一份关于镰状红细胞贫血症的报告,其中肯定了近几年批准上市3款新药的疗效,包括Endari、Adakveo和Oxbryta,但ICER提到这3款新药的价格偏高,特别是Adakveo和Oxbryta。本文简要介绍了以上3款治疗镰状红细胞贫血症新药的疗效和价格。
镰状红细胞贫血症(sickle cell disease,SCD)是由血红蛋白β链中的基因突变引起的终身遗传性血液疾病,会形成异常的镰状血红蛋白(HbS)。僵硬的HbS不仅会导致溶血性贫血,最终造成多器官损伤和早期死亡,还会堵塞毛细血管和小血管,血管阻塞危象(vaso-occlusive crisis,VOC)是SCD患者的主要症状之一。SCD患者从孩童期便会受到不可预知和反复发作的严重疼痛或危机,常导致心理和身体残疾。
多年来,SCD仅有一种治疗性药物--羟基脲(Hydroxyurea),这种化疗药物能降低VOC 50%的发生率,但会引起严重的毒副反应,具有致癌风险,使用受到限制。SCD患者亟待新型治疗药物。自2017年到2019年,FDA先后批准了3款SCD新药,分别为Endari、Adakveo和Oxbryta。
Endari
2017年7月7日,Emmaus开发的Endari(Pharmaceutical grade L-Glutamine,L-谷氨酰胺口服粉剂)获得美国FDA的批准,作为处方口服疗法用于减少5岁及以上SCD成人和儿童患者的急性并发症。Endari是近20年来首个用于减少成人SCD急性并发症的治疗方法。Endari通过提高烟酰胺腺嘌呤二核苷酸(NAD)的氧化还原电位来减少对红细胞的氧化损伤。
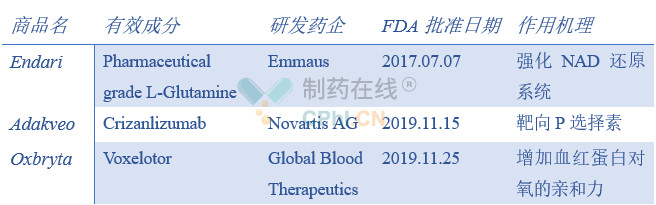
FDA批准Endari是基于一项包含230名SCD患者的III期研究,患者按2:1比例随机接受Endari(n=152,0.3g/kg,每天两次口服)或安慰剂(n=78)治疗。治疗48周后,试验结果显示,与安慰剂组相比,Endari组患者镰状细胞危象减少25%(p=0.005),住院率减少33%(p=0.005),累计住院天数减少41%(p=0.02)。
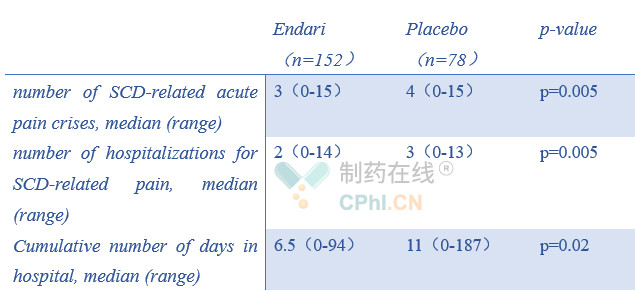
该III临床研究中,Endari组最常见不良反应(发生率高于10%)有便秘、恶心、头痛、腹痛、呕吐、肢端疼痛、背痛和胸痛。
Adakveo
2019年11月15日,Novartis潜在重磅疗法Adakveo(crizanlizumab)获得FDA批准上市,用于在16岁以上SCD患者中降低VOC的发生频率。Adakveo原定的PDUFA日期为2020年1月15日,此次批准比预期提前了3个月。
Adakveo是一款靶向P选择素(P-selectin)的单克隆抗体,通过阻断P选择素介导的多细胞粘附预防SCD患者的VOC发生。P选择素是一种在血管内皮细胞和血小板上发现的粘接分子,有助于细胞间的相互作用,从而造成多细胞粘连和聚集,进而阻塞血管。
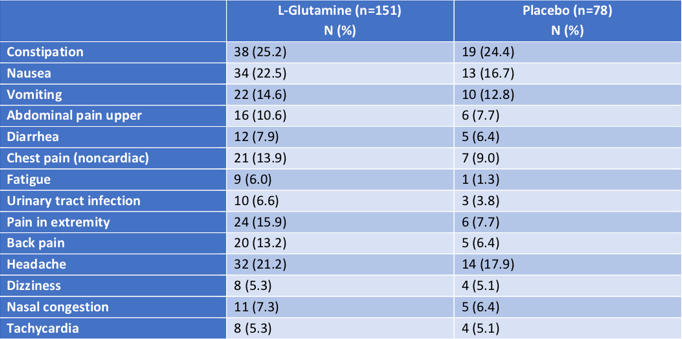
SUSTAIN是一项随机、安慰剂对照的II期临床研究,旨在评估Adakveo联用或不联用羟基脲预防SCD患者经历VOC的疗效和安全性。数据显示,与安慰剂相比,Adakveo(5mg/kg)将VOC中位年发病率显著降低了45.3%(1.63 vs 2.98,p=0.01),Adakveo组在治疗期间没有经历任何VOC的患者比例是安慰剂组的2倍以上(35.82% vs 16.92%,p=0.013),接受首次VOC治疗的中位时间是安慰剂组的3倍(4.07个月 vs 1.38个月,p=0.001),中位年住院天数减少了42%(4.00 vs 6.87,p=0.45)。
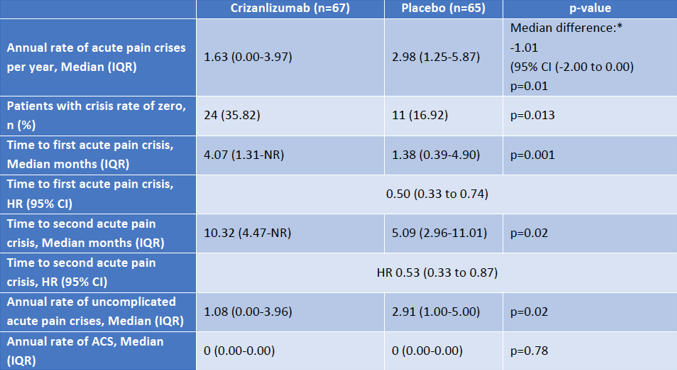
SUSTAIN试验中,Adakveo组患者最常见的不良反应(发生率≥10%)包括背痛、恶心、发热和关节痛,大多数不良反应为轻度到中度(1级或2级)。
Oxbryta
2019年11月25日,Global Blood Therapeutics(GBT)宣布FDA批准其Oxbryta(voxelotor)上市,用于治疗成人和12岁以上青少年患者的SCD,比PDUFA预定日期提前了3个月。
Voxelotor(GBT400)是一款每日口服一次的小分子SCD治疗药物,通过增加血红蛋白对氧的亲和力发挥效用,有潜力改善溶血性贫血和氧运输,并有可能潜在地改变SCD的进程。
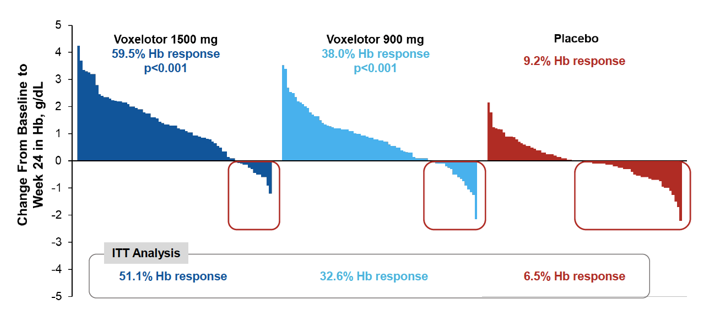
Voxelotor提前获批是基于一项随机、双盲、安慰剂对照的III期研究HOPE的积极结果,该研究旨在评估2种剂量水平的voxelotor(1500mg和900mg,每日一次口服给药)与安慰剂治疗SCD的疗效和安全性,主要终点为治疗24周后血红蛋白(Hb)含量提高 > 1 g/dL的患者比例和安全性数据。
数据显示,治疗24周后,1500 mg、900 mg Voxelotor组Hb水平提高超过1 g/dL的患者比例分别为51.1% (p<0.001)和32.6% (p<0.001),显著高于安慰剂组的6.5%,达到主要终点。此外,1500 mg Voxelotor组患者Hb水平从基线8.6 g/dL提高到9.8 g/dL,并且展现出显著和持久的Hb水平改善。
ICER:售价太高了!
比较以上三款SCD新药,Adakveo可以显著减少SCD患者的疼痛危象,但却不能减少患者住院时间或提高患者质量生活时间;Oxbryta的优势在于可以提高患者血红蛋白含量,但就减少住院时间或提高质量生活时间的效果还未显现出来,提高血红蛋白含量的长期收益还不清楚;再有Endari,也可以减少患者的疼痛危象。
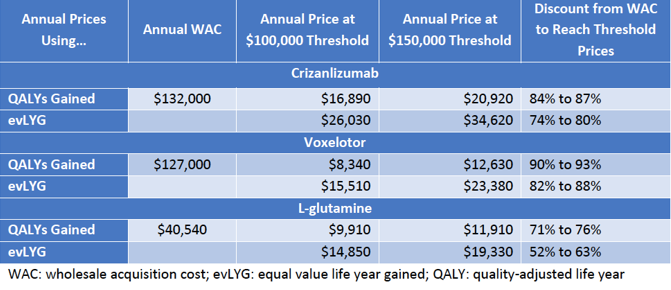
Adakveo、Oxbryta和Endari有一个共同点,那就是它们售价太高了!在ICER的定义中,一款药物的成本-收益门槛(cost-effectiveness thresholds)为10-15万美元每质量调整生命年(Quality-Adjusted Life Year,QALY)。ICER根据药物的疗效、患者健康状况的改善,计算出以目前Adakveo售价需要降低84-87%才能达到QALY的成本-收益门槛,Oxbryta要降低90-93%,Endari要降低71-76%。
除了近年来批准上市的Adakveo、Oxbryta和Endari,还有很多处于临床阶段的SCD产品,如基因疗法Zynteglo/Lentiglobin、泛选择素抵制剂Rivipansel、基因编辑疗法CTX001等,期待更多的创新疗法进入市场。
参考来源:
1.Crizanlizumab, Voxelotor, and L-Glutamine for Sickle Cell Disease: Effectiveness and Value;
2.Results From the Randomized, Placebo-Controlled, Phase 3 Hemoglobin Oxygen Affinity Modulation to Inhibit HbS Polymerization (HOPE) Trial of Voxelotor in Adults and Adolescents With Sickle Cell Disease。
作者简介:知行,用简单的语言讲述不简单的未来,一个不断前行的医药人。
点击下图进行CPhI & P-MEC China 2020观众预登记!



合作咨询
![]() 肖女士
肖女士
![]() 021-33392297
021-33392297
![]() Kelly.Xiao@imsinoexpo.com
Kelly.Xiao@imsinoexpo.com
 2006-2025 上海博华国际展览有限公司版权所有(保留一切权利)
沪ICP备05034851号-57
2006-2025 上海博华国际展览有限公司版权所有(保留一切权利)
沪ICP备05034851号-57