格列卫(伊马替尼)在2001年上市后,更多的制药公司受到鼓舞,投入更多小分子肿瘤靶向药物的研究,也逐渐成为携带特殊基因突变肿瘤治疗的主流,高选择性RET抑制剂将在2020年上市。
RET原癌基因的发现和多靶点抑制剂的运用
RET(Rearranged during transfection)基因首次于1985年在重组人淋巴瘤DNA中发现,RET位于10号常染色体长臂,染色体的重组常会导致RET基因中间断裂后与不同的上游基因发生融合,进而形成驱动肿瘤细胞增殖的融合基因。在1990年和2012年先后在甲状腺乳头状癌、肺腺癌和慢性髓系白血病中发现这一变异。RET的异常激活主要有三种机制包括框内RET基因融合,RET基因定向突变和RET基因过表达。
目前发现,RET基因融合在NSCLC患者中的发生率约为1-2%,在甲状腺乳头状癌(约占所有甲状腺癌的85%)中,其发生率为10%-20%。甲状腺髓样癌(MTC)中RET基因体突变的发生率约为60%。最常见的突变位点是M918T。其他仅有<1%的RET变异出现的瘤种,包括食管癌、乳腺癌、胰 腺癌等。
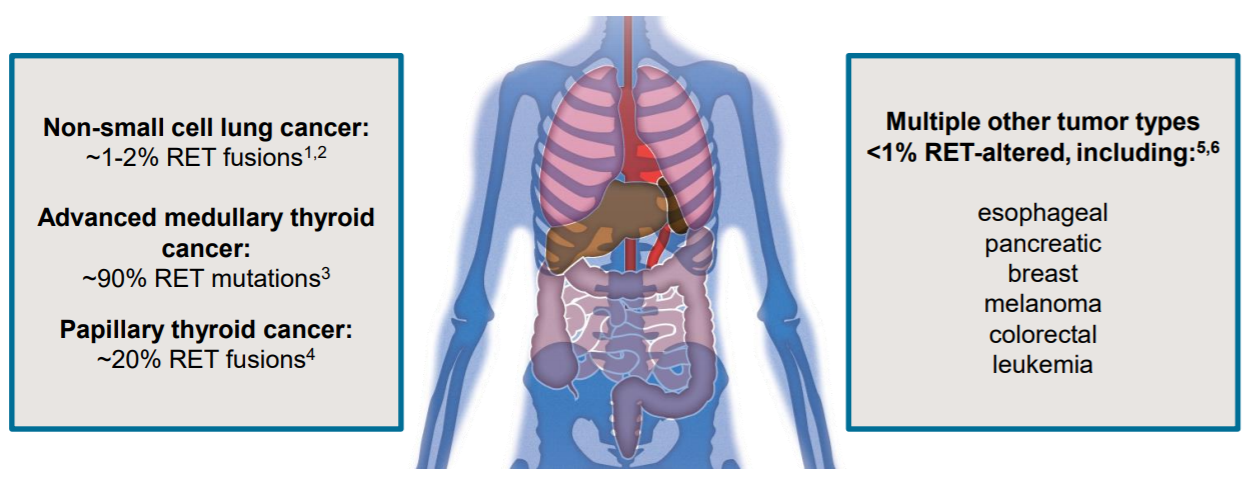
图1 RET原癌基因在各种癌种中的比例
携带RET融合的癌症和RET突变的MTC主要依靠这一激活的蛋白激酶维持它们的增殖和生存。这种依赖性称为“癌基因成瘾”,让这些肿瘤对靶向RET的小分子抑制剂非常敏感。
早在2010年Vandetanib被FDA批准用于甲状腺髓样癌,也是有抑制RET融合和M918T点突变活性的药物,但这个多靶点的靶向药其实原本的定位是VEGFR抑制剂,类似的还有Cabozantinib, Sorafenib, Lenvatinib等,都被FDA批准用于甲状腺癌。但由于对RET的选择性不高,常出现脱靶效应,包括恶心呕吐、腹泻、皮疹、高血压等,限制了患者的使用,克服这些的方法就是找到高选择性RET抑制剂。
2家肿瘤新秀同场角逐高选择性RET抑制剂
Blueprint Medecines和Loxo Oncology,两家公司的高选择性RET抑制剂——BLU-667和LOXO-292,同时在2017年初进入I期试验,都采用了I/II期剂量爬坡并在多个瘤种队列的方法,开始探索在包括RET融合初治和经治的NSCLC,RET突变初治和经治甲状腺髓样癌和其他RET变异的瘤种,安全和有效性。
两个试验也都基本在同一时间,分别在2018年的AACR和ASCO上发布试验了I期试验结果。
表1 BLU-667和LOXO-292 的I/II期试验基线对比
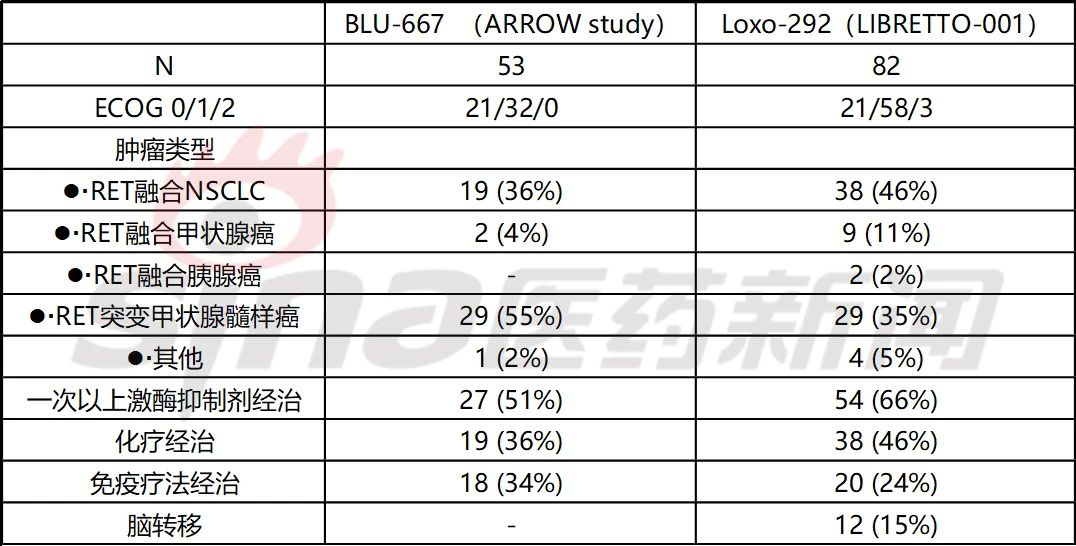
从纳入人群看,BLU-667纳入了RET突变MTC患者比例更高,而LOXO-292更多纳入了更多病情更严重的患者,包括身体状况较弱较高比例ECOG为2分,接受过更多次的激酶抑制剂治疗和有脑转移的患者。
从剂量递增试验上看,Loxo-292试验中在同一患者允许剂量递增,而BLU-667仍保留原始的3+3剂量递增方式,使得LOXO-292剂量递增组虽然较多,但爬坡速度也没有减慢。最终BLU-667和LOXO-292的II期推荐剂量分别为400mgQD和160mgBID。
从安全性看,两药均安全耐受,没有出现4级不良反应,3级不良反应发生率也较低。
从整体疗效看,BLU-667和LOXO-292在RET突变人群ORR类似,分别为40%和45%。再RET融合NSCLC和RET突变的MTC人群,LOXO-292的ORR能达到77%和45%。在任何类型的RET融合瘤种中,融合配体无论是否为KIF5B,LOXO-292的ORR均能达到81%。而BLU-667在RET融合NSCLC和RET突变的MTC人群的ORR尽管分别为50%和40%,但在300/400mg QD 剂量组,8周治疗ORR为35%,在16周和24周治疗后,ORR提升至56%和62%,应答率似乎能随着用药时间延长而增加。
基于LOXO-292在I/II期 LIBRETTO-001的试验结果,于2018年9月获得美国FDA突破性疗法认定,用于经治的携带RET基因变异的NSCLC和MTC患者。
但仅从小样本量的早期临床试验中得出LOXO-292疗效优于BLU-667的结论,还为时尚早。
海外市场和申请上市之争
两家创新药企继续进行疗效探索试验,竞争也开始进入了中国,这个肺癌大国市场。
2018年6月,基石药业与Blueprint Medicines达成独家合作协议,获得了包括pralsetinib(BLU-667)、avapritinib、fisogatinib在内的三种药物在大中华区的独家开发和商业化授权,Blueprint Medicines保留这三款药物在世界其他地区的相关权利。
2019年基石快速启动了ARROW study国际多中心中国地区试验,7月入组了第一例受试者,12月完成了经含铂化疗的RET融合NSCLC队列的入组,基石计划2020年下半年提交NMPA上市申请。
2018年4月,BLU-667获得美国FDA授予的孤儿药资格,治疗RET融合的NSCLC患者。2019年2月和5月,分别获得FDA授予的两个适应症突破性疗法认定,用于经治RET突变MTC患者,和RET融合NSCLC患者。
而Loxo Oncoloy在2019年1月被礼来以80亿美元在收购后,LOXO-292也自然成为礼来用来复兴肿瘤管线的主要产品。2020年1月,礼来也在中国开始了LOXO-292用于RET融合阳性的实体瘤、RET突变的MTC和其他存在RET激活的肿瘤的II期试验。
两者疗效数据的交锋又到了2019年,分别在Word Lung和Asco上发布了I/II期试验更新结果。
礼来的selpercatinib(LOXO-292)在RET融合NSCLC和甲状腺癌的应答率分别能达到68%和62%,基于此,礼来在2020年1月率先获得用于RET融合NSCLC和甲状腺癌、RET突变MTC上市申请的优先审评。
Pralsetinib在先前未接受治疗、先前接受过含铂化疗的RET融合阳性NSCLC患者中,ORR分别为73%、60%,PFS和DOR都尚未达到。基于此,Blueprint Medicines也在2020年4月初完成向FDA递交pralsetinib治疗RET融合NSCLC的新药上市滚动申请(rolling NDA),且也进行优先审评申请。
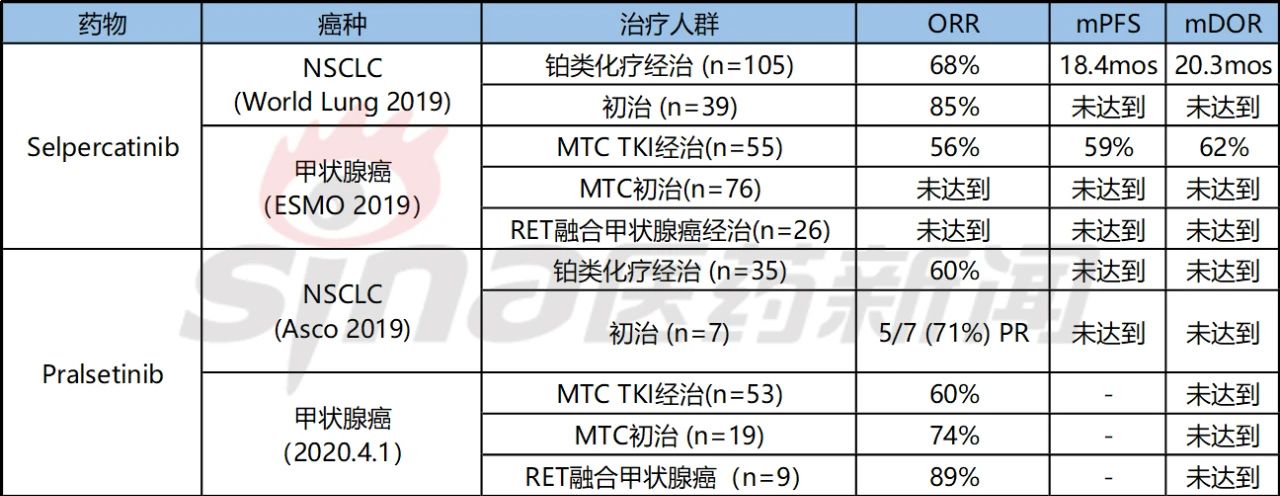
表2 LOXO-292和BLU-667最近公布的试验结果
获得优先审评资格,意味着NDA将在6个月内完成,礼来的LOXO-292于Blueprint,成为全球上市的高选择性RET抑制剂,而Pralsetinib更有希望成为中国上市的RET抑制剂。
从BLU-667公布的NSCLC试验中,似乎应答时间和疾病进展时间更长,且4名接受过LOXO-292治疗的患者,对BLU-667治疗也有应答。这意味着本是同台竞争的LOXO-292和BLU-667,并不需要以更优效来占据市场,而是都能给患者治疗选择。
基于2020年4月更新的Pralsetinib用于经治RET突变MTC试验数据,ORR达到60%, 90%的患者达到18个月的持续缓解,Blueprint Medicines计划在2020年第二季度向美国FDA提交针对该适应症的新药上市申请。
推动基因组学癌症药物的开发
Blueprint Medicines于2008年在美国麻省剑桥成立美国成立,联合创始人就包括了大名鼎鼎的,曾经领导格列卫研发的科学家Nicholas Lydon, Brian Druker 和 Charles Sawyers。届时癌症基因组学已在NIH等项目的支持下得到快速发展,Blueprint在创建之初就是想构建一个平台,用计算机算法分析癌症基因组数据,以寻找癌症相关潜在分子异常,包括检测来自不同癌症类型的多个数据集是否有相同酶的突变,在此基础上也建立专有化合物文库,测试可抑制癌症相关激酶活性的化合物,BLU-667就是早期开发的其中一个化合物。

图2 Nicholas Lydon等三人在获得2009年Lasker奖的合影
Josh Bilenker在癌症免疫治疗药物开始成为热门的2013年,仍决定押注在基因组学上,在美国斯坦福成立了Loxo Oncology,也致力开发用于治疗携带罕见突变的癌症患者。同年,Loxo开始与Array BioPharma达成联合开发合作协议,Array为Loxo提供化合物设计等临床前服务,Loxo也加大对靶点选择的投入,这一合作诞生的一系列化合物中就包括了已经上市的Vitrakvi,和Loxo-292。
目前礼来和Blueprint都在正在同步将两药在RET变异的NSCLC、MTC一线治疗,和RET变异肿瘤12岁以上儿童患者人群推进,包括选择与培美曲塞+铂类化疗±帕博利珠单抗对比用于治疗RET融合阳性NSCLC的III期试验,RET突变MTC一线治疗则与Cabozantinib 或Vandetanib头对头比较。
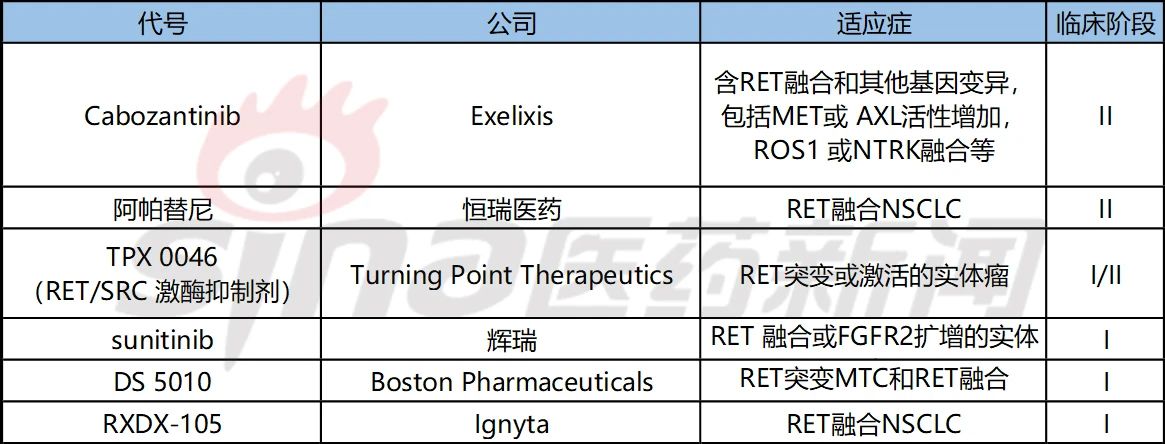
根据Pharmadigger数据库,目前其他正在开发RET抑制剂都处于临床早期。
表3 目前正在进行临床开发的RET抑制剂



合作咨询
![]() 肖女士
肖女士
![]() 021-33392297
021-33392297
![]() Kelly.Xiao@imsinoexpo.com
Kelly.Xiao@imsinoexpo.com
 2006-2025 上海博华国际展览有限公司版权所有(保留一切权利)
沪ICP备05034851号-57
2006-2025 上海博华国际展览有限公司版权所有(保留一切权利)
沪ICP备05034851号-57