新药介绍
美国FDA加速批准Incyte的Pemigatinib(商品名为Pemazyre?)用于既往接受过治疗的携带FGFR2融合或其他重排的不可切除局部晚期或转移性胆管癌成人患者。Pemazyre?是FDA批准的首个也是唯一一个用于治疗胆管癌的药物。该品种曾获得美国FDA授予的孤儿药资格、突破性疗法和优先审查认定。
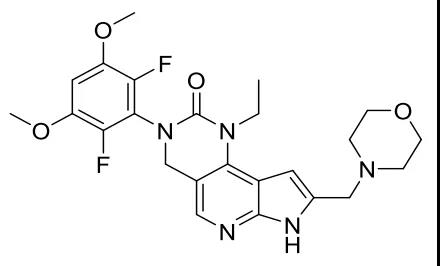
图1. Pemigatinib结构式
信达生物和Incyte达成战略合作和独家授权许可协议,推进Pemigatinib(FGFR1/2/3抑制剂)、Itacitinib(JAK1抑制剂)及Parsaclisib(PI3Kδ抑制剂)的单药或联合治疗在中国在中国(包括港澳台)的临床开发与商业化。根据合作协议规定,Incyte公司将收到信达生物支付的4000万美元首付款,以及预计2019年在中国首次递交新药申请后的第二笔2000万美元现金付款。在中国Pemigatinib片剂处于评价胆管癌受试者疗效和安全性的临床II期研究。
Pemazyre?的获批是基于一项多中心、开放标签、单臂研究FIGHT-202队列A的数据,入组107名患者既往接受过治疗,并且携带FGFR2基因融合或重排,每日口服一次Pemigatinib 13.5 mg,21天为一个周期,直至出现放射学疾病进展或不可耐受**。试验结果表明,Pemazyre?的总缓解率(ORR)达到36%,达到了主要终点,其中2.8%的患者完全缓解,33%的患者部分缓解。中位缓解持续时间(DOR)为9.1个月。
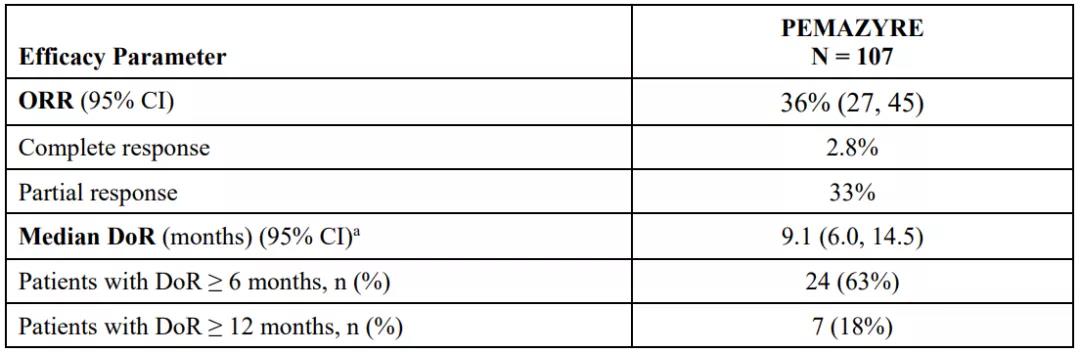
图2. FIGHT-202研究的数据
胆管癌治疗药物竞争格局
胆管癌是一种罕见的恶性肿瘤。根据其起源部位可以分为肝内胆管癌(iCCA)和肝外胆管癌。胆管癌患者预后较差,通常诊断出来时已是后期或晚期,。胆管癌发病率因地域而异,北美和欧洲地区的发病率为0.3-3.4/100000。FGFR2基因融合或重排几乎仅见于肝内胆管癌,突变率大约10%-16%。
对于手术切除或伴有转移的进展期胆管癌,主要推荐吉西他滨联合铂类抗肿瘤药物(顺铂、奥沙利铂等)和(或)替吉奥的化疗方案,加用埃罗替尼可增强抗肿瘤效果。对于不可切除的胆管癌应用基于上述方案的新辅助化疗,可能使肿瘤降期,获得手术切除机会。
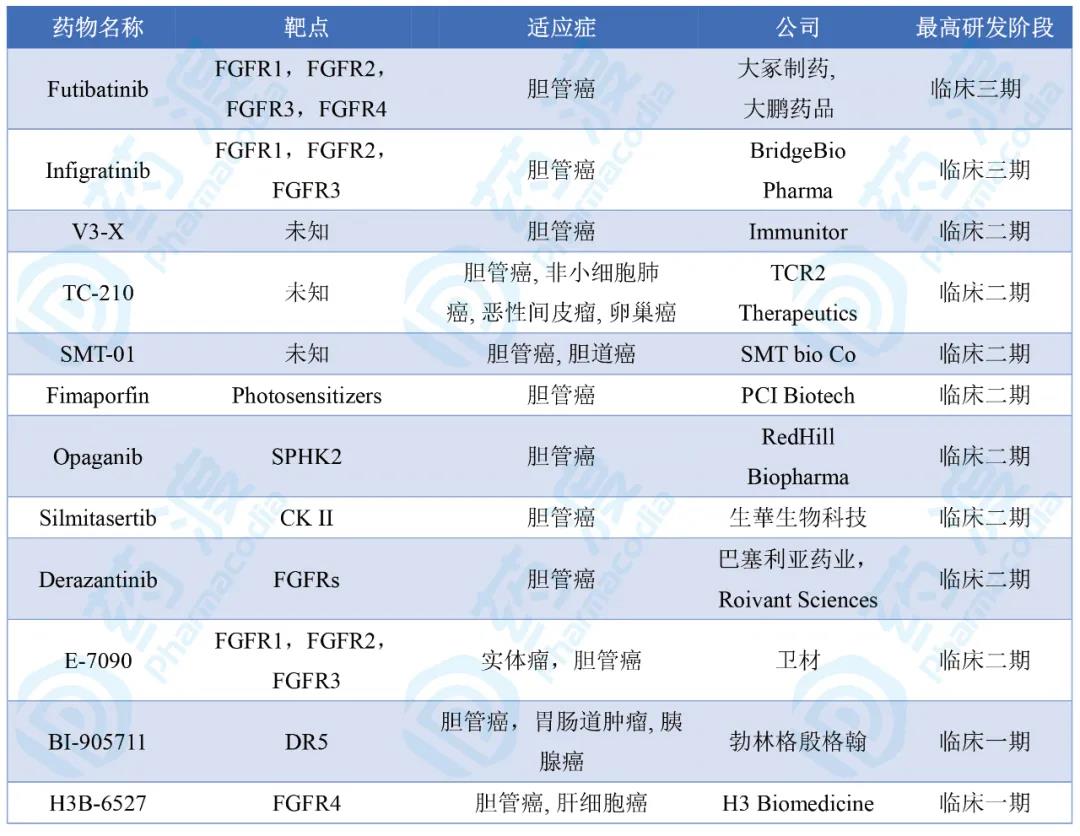
截止发稿,有12个胆管癌在研药物,三期2个,二期8个,一期2个。该领域中未见国1类研发药物。
临床在研药物大多是纤维细胞生长因子受体(FGFRs)抑制剂。FGFRs在肿瘤细胞增殖、生存、迁移、新生血管形成中发挥着重要作用。FGFRs基因的融合、重排、易位和扩增与多种癌症的发生和进展密切相关。
第一梯队:Futibatinib和Infigratinib。
Futibatinib:大鹏药品工业和大冢制药共同研发,处于临床三期,用于治疗胆管癌。
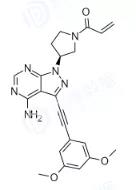
图3. Futibatinib结构式
Infigratinib:是一种纤维细胞生长因子受体1-3抑制剂,用于治疗胆管上皮癌的临床三期,以及治疗血液系统恶性肿瘤和头颈癌临床二期试验。该品种最初由Novartis研发,之后授权给QED Therapeutics(BridgeBio Pharma的子公司)。
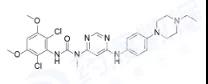
图4. Infigratinib结构式
表1. 全球拟用于胆管癌治疗的在研药物一览
靶向FGFR2的中国1类在研药物
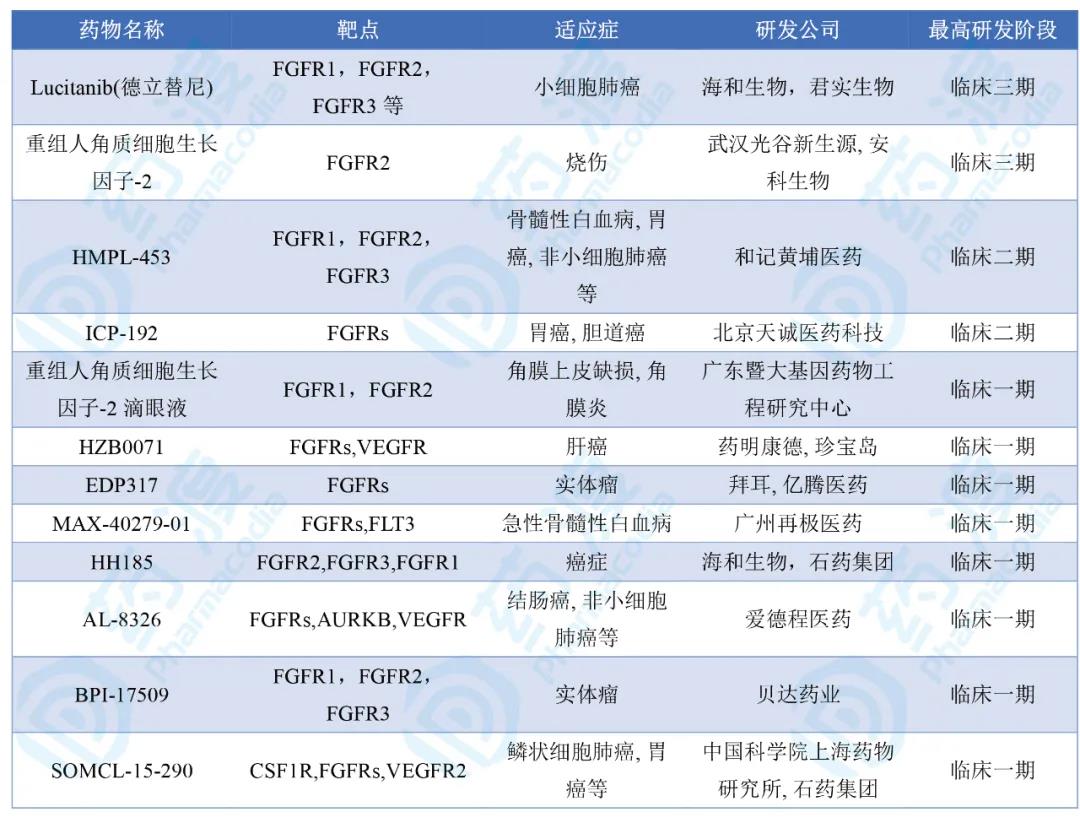
截止发稿,共有12款靶向FGFR2的中国1类在研药物,三期2款,二期2款,一期8款。处于第一梯队的是三期的Lucitanib和武汉光谷新生源开发的重组人角质细胞生长因子-2(KGF-2)。
KGF-2:目前治疗浅Ⅱ度烧伤的临床三期研究阶段。
Lucitanib(德立替尼):最初由爱德程研发(研发代码E-3810),是一种靶向选择性FGFR1–3、VEGFR1–3和PDGFRα/β酪氨酸激酶活性抑制剂,目前最高处于治疗实体瘤,例如小细胞肺癌的临床二/三期研究阶段和治疗妇科癌症的临床一期研究阶段。
表2. 靶向FGFR2的中国1类在研药物一览



合作咨询
![]() 肖女士
肖女士
![]() 021-33392297
021-33392297
![]() Kelly.Xiao@imsinoexpo.com
Kelly.Xiao@imsinoexpo.com
 2006-2025 上海博华国际展览有限公司版权所有(保留一切权利)
沪ICP备05034851号-57
2006-2025 上海博华国际展览有限公司版权所有(保留一切权利)
沪ICP备05034851号-57