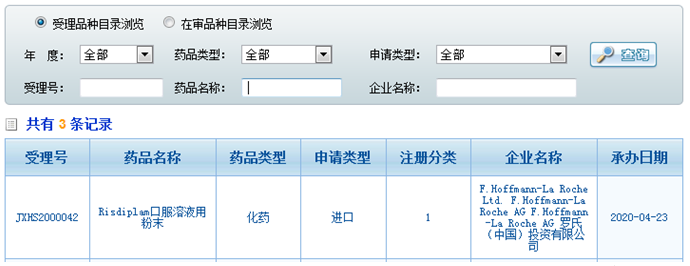
4月23日,据CDE官网罗氏脊髓性肌萎缩症药物risdiplam口服溶液用粉末的上市申请被CDE受理,据悉4月初FDA推迟了该药的PDUFA日期,预计今年8月底将会收到FDA的回复。
脊髓性肌萎缩症(SMA)是一种遗传性、进行性神经肌肉疾病,可导致毁灭性的肌肉萎缩和疾病相关的并发症。该病是2岁以下婴幼儿群体中的头号遗传病杀手,在新生儿中的患病率为1:6000-1:10000,中国大约有患儿3~5万人。
作为一种罕见病,目前全球获批的治疗药物非常有限,仅有渤健(biogen)的spinraza和诺华(novartis)的基因疗法zolgensma。其中spinraza是一种反义寡核苷酸,通过改变SMN2基因的剪接,增加全功能性SMN蛋白的生产,是全球首个获批治疗脊髓性肌萎缩症的药物,据悉该药在美国的价格是12.5万美元/针,首年需要注射6次,年治疗费用为75万美元,次年治疗费用降低一半至37.5万美元,治疗成本相当高。而zolgensma是由AveXis, Inc.开发的一款SMN1基因替代疗法,后被诺华收购,是FDA批准首款SMA基因疗法,该药在美国的定价更高,210万美元/支,被认为是 "史上最贵疗法"。
2018年5月,SMA被列入我国《第一批罕见病目录》。随后,渤健的Spinraza(即诺西那生)作为已在境外上市且临床急需的罕见病治疗新药被纳入优先审评审批程序,并顺利成为目前我国获批的首款且唯一一款SMA治疗药物。据悉该药被批准用于治疗5q脊髓性肌萎缩症(5q-SMA),其中5q-SMA是SMA的最常见类型,约占全部SMA病例的95%,该类型SMA是由5号染色体上的SMN1(运动神经元生存蛋白1)基因突变所引起的,因此得名5q-SMA。据悉,诺西那生在北京的零售价是699700人民币/支(5ml:12mg),高昂的治疗成本让很多患者望而却步。
risdiplam是一种口服液体、运动神经元存活基因2(SMN2)剪接修饰剂,旨在持续增加和维持中枢神经系统和外周组织中的SMN蛋白水平。该药口服给药后呈现全身性分布,可持续增加中枢神经系统和外周组织的SMN蛋白水平,已显示出可改善1型、2型、3型SMA患者的运动功能。在美国,该药于2017年1月被授予孤儿药资格,2017年4月被授予快速通道资格认定,未来顺利获批,将成为首个用于治疗SMA患者的口服药物。此外,相较于Spinraza和Zolgensma均用于1型SMA患者,risdiplam有望挑战还没有治疗选择的SMA患者人群。
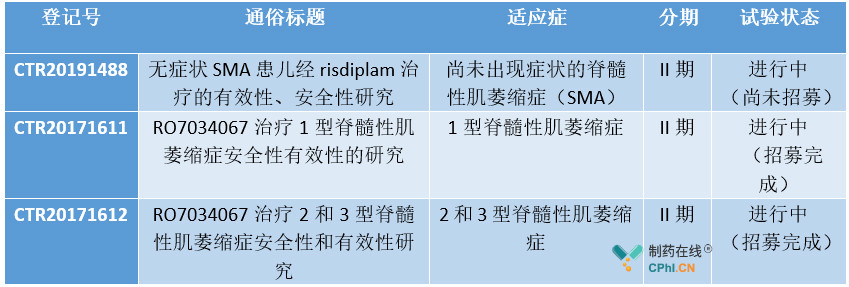
目前,据insight数据库risdiplam在国内共登记3项临床试验,且都处于进行中,笔者猜测risdiplam此次报产是根据国外临床试验数据。
相信随着我国近年来药品审批速度的加快,以及对罕见病的重视,笔者预计risdiplam将有望被纳入优先审评程序,加速在国内获批上市。届时,risdiplam将打破诺西那生在我国SMA领域的唯一地位,并凭借口服优势,成为其强劲对手。
参考资料:
[1]CDE官网
[2]insight数据库
点击下图进行CPhI & P-MEC China 2020观众预登记!立省100元门票



合作咨询
![]() 肖女士
肖女士
![]() 021-33392297
021-33392297
![]() Kelly.Xiao@imsinoexpo.com
Kelly.Xiao@imsinoexpo.com
 2006-2025 上海博华国际展览有限公司版权所有(保留一切权利)
沪ICP备05034851号-57
2006-2025 上海博华国际展览有限公司版权所有(保留一切权利)
沪ICP备05034851号-57