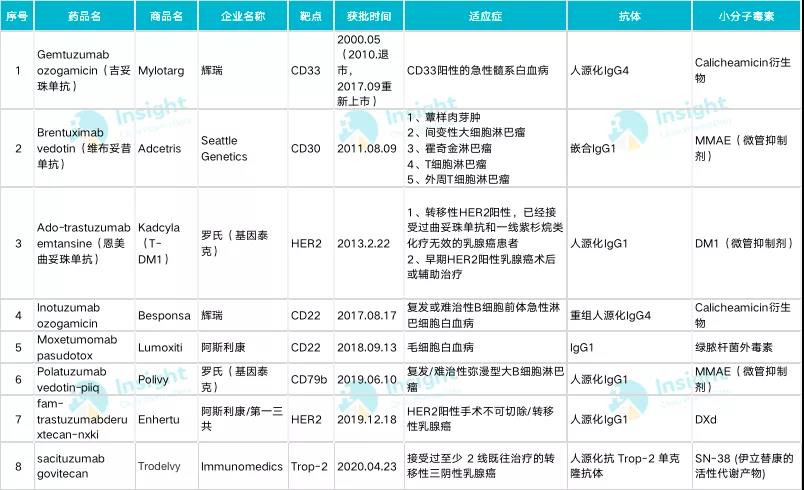
根据 FDA 官网 4 月 22 日消息, Immunomedics 公司的 ADC 药物 sacituzumab govitecan(商品名 Trodelvy)获得 FDA 批准上市,用于接受过至少 2 线既往治疗的转移性三阴性乳腺癌,这一获批比预计时间早 1 个月,sacituzumab govitecan 成为全球第 8 个获批上市的 ADC 药物。

预计的获批时间是 2020 年 6 月,对于此次提前获批,FDA 药物评估和治疗中心 Richard Pazdur 医生称在新冠疫情大流行期间,FDA 重点关注癌症患者,因为他们是新冠肺炎的高危群体。美国 CDC 官网中也提到,癌症患者接受癌症治疗后可能导致患者免疫功能低下,机体抵抗新冠病毒的能力下降。
给三阴乳腺癌患者一种新的靶向治疗
全世界每 10 个乳腺癌中大约有 2 个是三阴乳腺癌。三阴性乳腺癌是一种不表达雌激素受体、孕激素受体和人表皮生长因子受体 2(HER2)的乳腺癌。因此,三阴性乳腺癌患者对激素治疗药物、靶向 HER2 的药物均无反应。
「转移性三阴性乳腺癌是一种侵袭性乳腺癌,治疗选择有限。 化学疗法一直是三阴性乳腺癌的主要治疗手段。Trodelvy 的获批上市给三阴乳腺癌患者的一种新的靶向治疗选择。」 Richard Pazdur 医生表示。
sacituzumab govitecan 是一种抗体偶联药物(ADC),由伊立替康 SN-38 活性代谢物与人源化抗 Trop-2 单克隆抗体(hRS7)偶联而成,可应用于多种实体瘤。Trop-2 靶点在许多人体肿瘤中表达,例如乳腺癌,宫颈癌,结肠癌和直肠癌,肾癌,肝癌,肺癌,卵巢癌,胰 腺癌和前列腺癌等,但在正常人类组织中仅表达有限;SN-38 是伊立替康(Camptosar)的活性代谢产物,有较强的胃肠道和血液学**。
2015 年 1 月,Immunomedics 获得 FDA 授予的 sacituzumab Govitecan 治疗三阴性乳腺癌快速通道资格,用于治疗先前因转移性疾病治疗失败的三阴性乳腺癌(TNBC)患者。
当时,Immunomedics 公司公布的数据显示,在入组的三阴乳腺癌患者中,有大约 30% 的患者通过计算机断层扫描显示出客观的缓解率(完全缓解和部分缓解),观察到的肿瘤缩小范围为 30% 至 100%;与 SN-38 母体药物伊立替康不同,sacituzumab govitecan 并未引起严重腹泻;该药的主要副作用为中性粒细胞减少症,可通过减少剂量或给予骨髓生长因子来控制。
2016 年 2 月,Immunomedics 宣布 sacituzumab govitecan 用于接受过至少两种先前针对转移性疾病的治疗无效的三阴性乳腺癌患者获得 FDA 突破性疗法通行证。
此次 Trodelvy 获批是基于 108 例转移性三阴乳腺癌患者的临床试验结果,这些患者接受过至少 2 次既往治疗。接受 Trodelvy 治疗后,ORR (总体缓解率) 为 33.3%,中位缓解时间为 7.7 个月。在对 Trodelvy 产生反应的患者中,有 55.6% 的疗效维持了 6 个月及以上,有 16.7% 的疗效维持了 12 个月及以上。
黑框警告
Trodelvy 的说明书中带有黑框警告,提醒医护人员注意用药后患者严重中性粒细胞减少和严重腹泻的风险。医护人员在给患者使用 Trodelvy 期间应定期监测患者的血细胞计数,可采用粒细胞集落刺激因子(G-CSF)进行治疗;此外需要监测患者腹泻情况,根据需要补充液体、电解质和给予其他药物。对于中性粒细胞减少症或腹泻,患者可能需要降低 Trodelvy 剂量或永久停用。
服用 Trodelvy 后最常见的副作用是恶心、中性粒细胞减少、腹泻、疲劳、贫血、呕吐、脱发、便秘、食欲下降、皮疹和腹痛。
Trodelvy 可能引起超敏反应,甚至会有严重的过敏反应。医护人员应该监测患者输液时的反应,如果发生严重或危及生命的过敏反应,停用 Trodelvy。如果患者服用 Trodelvy 时感到恶心或呕吐,医护人员可给患者使用止吐药进行预防性治疗;开始 Trodelvy 治疗后,尿苷二磷酸-葡萄糖醛酸转移酶 1A1(UGT1A1)活性降低的患者发生中性粒细胞减少的风险增加。
孕妇不应使用 Trodelvy,因为 Trodelvy 可能对胎儿或新生婴儿造成伤害。FDA 建议医疗保健专业人员告知育龄女性,在 Trodelvy 治疗期间以及最后一次给药后的 6 个月内使用有效的避孕方法。具有生殖潜力的女性伴侣的男性患者也应在 Trodelvy 治疗期间以及最后一次给药后 3 个月内进行避孕。
全球第 8 款 ADC
Trodelvy 的获批上市,全世界 ADC 药物增加到 8 款。
被誉为「生物导 弹」,ADC 类药物将抗体药的高度靶向特异性和小分子毒素的高**相结合,实现对肿瘤细胞的精准高效杀伤,有望实现床优效,已成为抗体药研发的热门方向。
已经批准上市的 7 款 ADC 药物均创下好的销售成绩。罗氏的恩美曲妥珠单抗表现最好,2019 年销售额高达 13.93 亿瑞士法郎,而且该药已于今年 1 月分在国内获批,商品名为赫赛莱,适应症为单药用于接受紫杉烷类联合曲妥珠单抗为基础的新辅助治疗后仍残存侵袭性病灶的 HER2 阳性早期乳腺癌患者的辅助治疗。此次,业界同样对 sacituzumab 寄予厚望,有分析师认为, sacituzumab 潜在收购价值为 71 亿美元。



合作咨询
![]() 肖女士
肖女士
![]() 021-33392297
021-33392297
![]() Kelly.Xiao@imsinoexpo.com
Kelly.Xiao@imsinoexpo.com
 2006-2025 上海博华国际展览有限公司版权所有(保留一切权利)
沪ICP备05034851号-57
2006-2025 上海博华国际展览有限公司版权所有(保留一切权利)
沪ICP备05034851号-57