1类化药临床审批概况
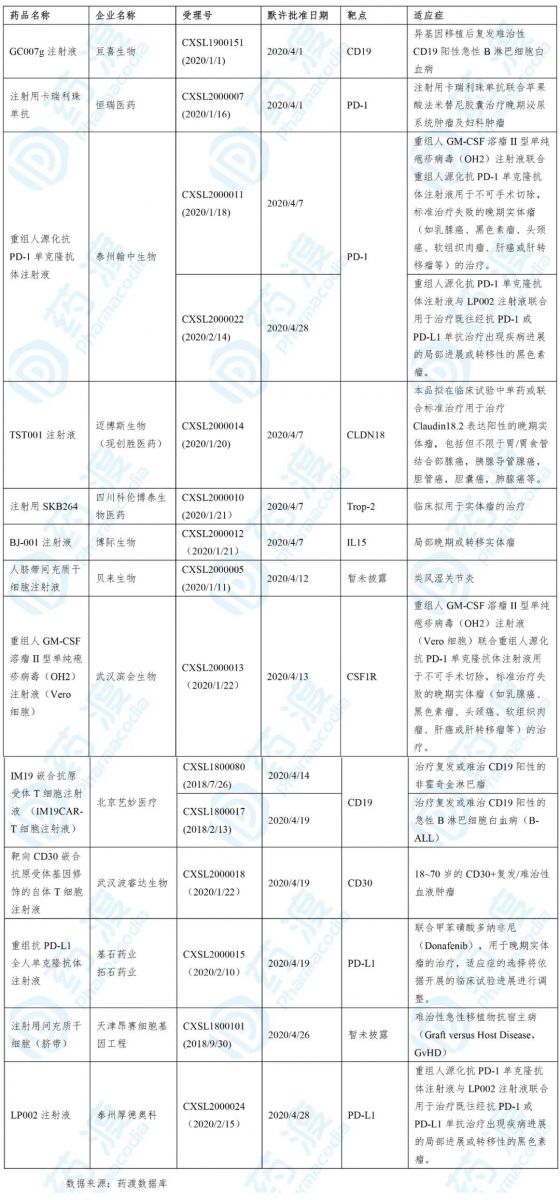
2020年4月,共有13个中国1类化药获得国家药品监督管理局(NMPA,原CFDA)的床试验默示许可,具体信息如下表所示:
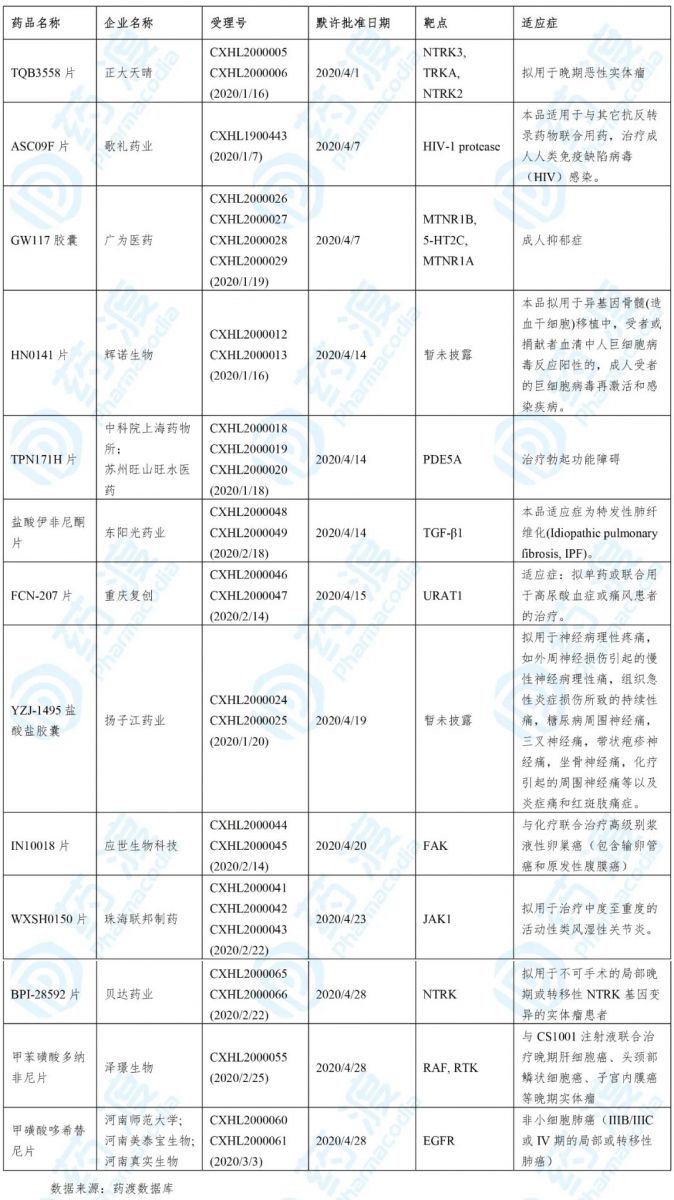
1. TQB3558片
TQB3558由正大天晴研发。2020年1月,该药的IND申请获得国家药品监督管理局(NMPA)承办(化药1类)。2020年4月,该药获得NMPA临床试验默示许可,用于治疗晚期实体瘤。
2. ASC09F片
ASC09F是由歌礼中国开发的一种由HIV蛋白酶抑制剂(ASC09)和HIV-1 蛋白酶抑制剂(利托那韦)组成的复方药物,用于治疗艾滋病和新型冠状病毒肺炎。
研发里程碑
2020年1月7日,该药的IND申请获得国家药品监督管理局(NMPA)承办,为化药一类。
2020年2月7日,开展临床试验(阶段不明),比较ASC09/利托那韦和洛必那韦/利托那韦在新型冠状病毒肺炎患者中的安全性和有效性(NCT04261907)。
2020年4月,该药获得NMPA临床试验默示许可,用于治疗成人人类免疫缺陷病毒(HIV)感染。
3. GW117胶囊
GW-117由北京广为医药科技公司和南京广为医药科技公司研发,是阿戈美拉汀的结构优化物,克服了后者的极低口服生物利用度和极高变异系数缺陷,并有望解决由此带来的患者肝酶升高风险。
2020年1月,该药的IND申请获得国家药品监督管理局(NMPA)承办(化药1类)。
2020年4月,该药获得NMPA临床试验默示许可,用于治疗成人抑郁症。
4. HN0141片
HN-0141由辉诺生物医药科技公司研发。2020年1月,该药的IND申请获得国家药品监督管理局(NMPA)承办(化药1类)。2020年4月,该药获得NMPA临床试验默示许可,拟用于异基因骨髓(造血干细胞)移植中,受者或捐献者血清中人巨细胞病毒反应阳性的,成人受者的巨细胞病毒再激活和感染疾病。
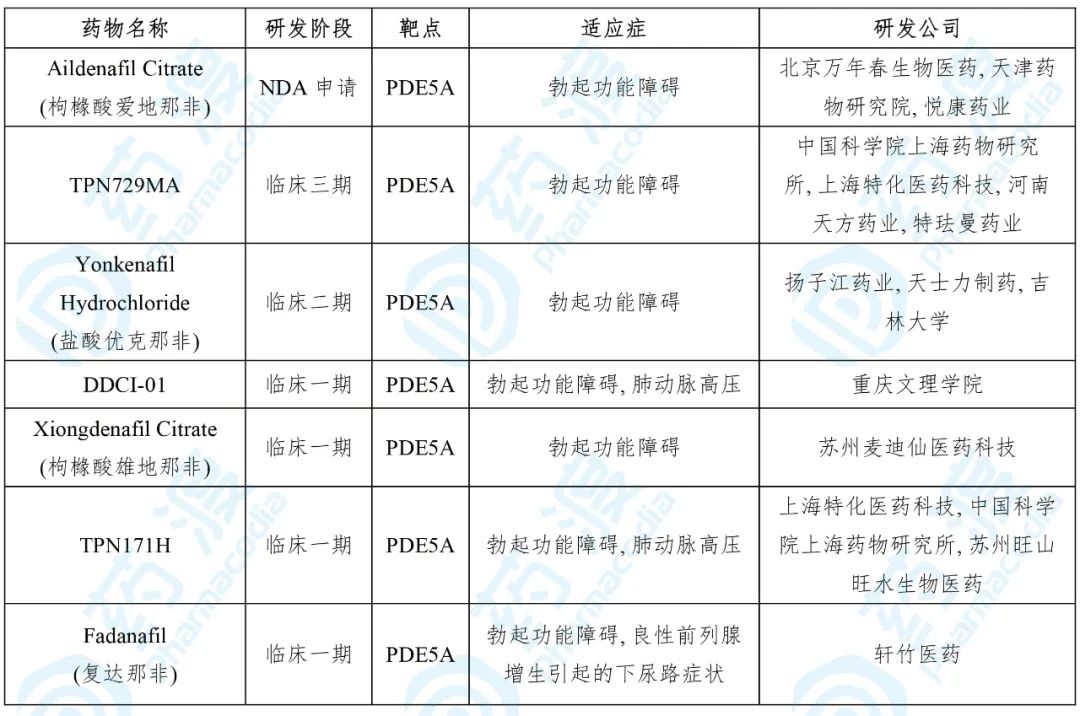
5. TPN171H
由中国科学院上海药物研究所和苏州旺山旺水生物医药有限公司开发的TPN171H是一种PDE5抑制剂,处于治疗肺动脉高压和勃起功能障碍的临床一期。
研发里程碑
2020年1月,该药的IND申请获得国家药品监督管理局(NMPA)承办(化药1类)。
2020年4月,该药获得NMPA临床试验默示许可,用于治疗勃起功能障碍(ED)。
2018年8月,TPN171H片在中国健康人中多次口服给药、单中心、随机、双盲、安慰剂平行对照耐受性和药代动力学研究(CTR20181142)已在中国招募患者。
2018年5月,食物对中国健康受试者口服TPN171H片药代动力学特征影响的研究(CTR20171237)已在中国招募患者。
2017年12月,TPN171H片在中国健康人中的耐受性和药代动力学I期临床研究(CTR20171238)在中国启动。
2014年5月,中国科学院上海药物研究所联合上海特化医药科技、山东特珐曼药业(上海特化医药科技子公司)、苏州旺山旺水生物医药在中国提交临床试验申请(化药1类)获CDE受理,并于2016年3月1日获得临床试验批件。
目前靶向PDE5A的中国1类药物如下表所示:
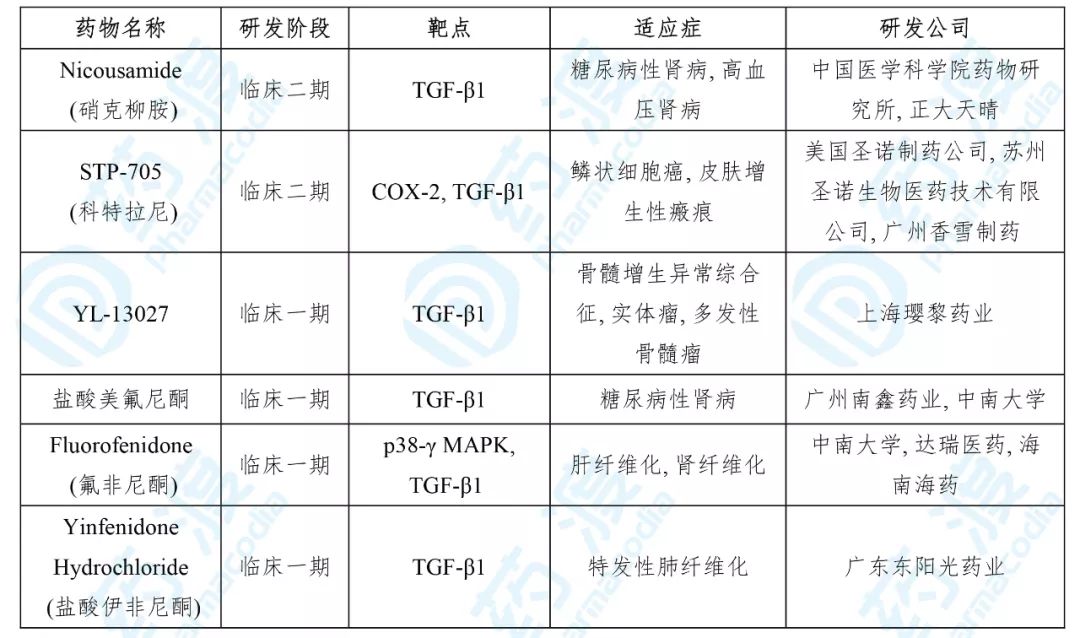
6. 盐酸伊非尼酮片
由广东东阳光药业有限公司开发的盐酸伊非尼酮处于治疗特发性肺纤维化的临床一期。
研发里程碑
2020年2月18日,该药的IND申请获得国家药品监督管理局(NMPA)承办,为化药一类。2020年4月,该药获得NMPA临床试验默示许可,用于治疗特发性肺纤维化。
2017年8月10日,东阳光药业的1类新药伊非尼酮(yinfenidone,HEC585)获得FDA孤儿药资格认定,用于治疗特发性肺纤维化(IPF)。
2017年2月22日获得美国FDA许可正式进入I期临床,已在科文斯(美国)I期临床试验中心顺利启动并于2017年5月2日成功完成2例受试者的首次给药,标志着东阳光新药海外临床研究的正式开始。
2016年8月,广东东阳光药业向中国食品药品监督管理总局(CFDA)提交临床试验申请(化药1.1类),2017年3月22日获得临床试验批件。
目前靶向TGF-β1的中国1类药物如下表所示:
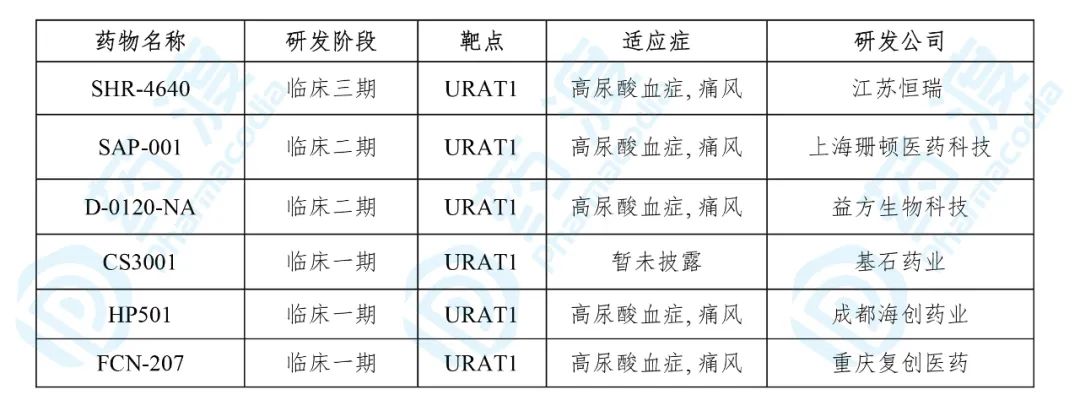
7. FCN-207片
FCN-207由重庆复创医药研发。 2020年2月14日向NMPA提交了IND申请。2020年4月,该药获得NMPA临床试验默示许可,拟单药或联合用于高尿酸血症或痛风患者的治疗。
目前靶向URAT1的中国1类药物如下表所示:
8. YZJ-1495盐酸盐胶囊
YZJ-1495由上海海雁医药科技有限公司和上海海尼药业有限公司联合研发。
2020年1月,该药的IND申请获得国家药品监督管理局(NMPA)承办(化药一类)。
2020年4月,该药获得NMPA临床默示许可,拟用于治疗神经病理性疼痛,如外周神经损伤引起的慢性神经病理性痛,组织急性炎症损伤所致的持续性痛,糖尿病周围神经痛,三叉神经痛,带状疱疹神经痛,坐骨神经痛,化疗引起的周围神经痛等以及炎症痛和红斑肢痛症。
9. IN-10018片
IN-10018是由应世生物科技有限公司研发的粘着斑激酶(FAK)抑制剂,处于治疗腺癌,卵巢癌和转移性非小细胞肺癌的临床一期。
研发里程碑
2020年2月14日,该药的IND申请获得国家药品监督管理局(NMPA)承办,为化药一类。2020年4月,该药获得NMPA临床默示许可,与化疗联合治疗高级别浆液性卵巢癌(包含输卵管癌和原发性腹膜癌)。
2020年1月22日,该药的IND申请获得国家药品监督管理局(NMPA)承办,为化药一类。2020年3月,该药获得NMPA临床默示许可,与PD1联合治疗晚期或转移性非小细胞肺癌。
2019年10月,该药的IND申请获得国家药品监督管理局(NMPA)承办,为化药一类。
2019年12月,该药获得NMPA临床默示许可,拟用于治疗局部晚期或转移性胃或胃食管交界处腺癌。
2019年8月,该药获得美国食品药品监督管理局(FDA)的临床试验许可(IND)。
10. WXSH0150片
WXSH-0150由珠海联邦制药开发的小分子靶向JAK1抑制剂。2020年2月22日,该药的IND申请获得国家药品监督管理局(NMPA)承办,为化药一类。2020年4月,该药获得NMPA临床默示许可,用于治疗类风湿性关节炎。
11. BPI-28592片
BPI-28592由贝达药业开发。2020年2月22日,BPI-28592的IND申请获得国家药品监督管理局(NMPA)承办,为化药一类。2020年4月,该药获得NMPA临床默示许可,拟用于治疗不可手术的局部晚期或转移性NTRK基因变异的实体瘤。
12. 甲苯磺酸多纳非尼片
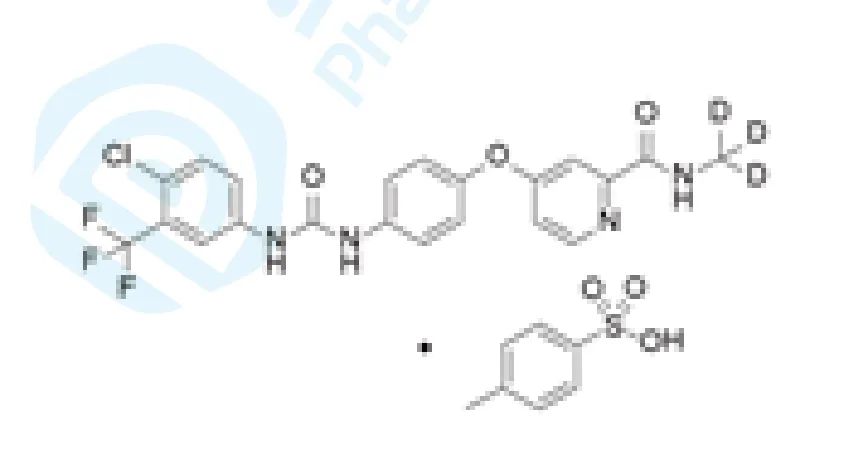
甲苯磺酸多纳非尼是泽璟生物研发的氘取代索拉非尼衍生物,是一款口服多激酶抑制剂,具有双重的抗肿瘤作用: 通过抑制 Raf 家族的丝氨酸 - 苏氨酸激酶并抑制下游 Raf/MEK/ERK 信号传导通路而直接抑制肿瘤细胞的增殖; 通过抑制 VEGFR 和血小板衍生生长因子受体 ( PDGFR )等多种受体酪氨酸激酶的活性阻断肿瘤新生血管的形成,间接抑制肿瘤细胞的生长。 此药对肝细胞癌、晚期直肠癌及二线治疗局部晚期 / 转移性**碘难治性分化型甲状腺癌的研究,目前处于治疗大肠癌和甲状腺癌的临床三期研发阶段、肝癌的临床二 / 三期研究 阶段、胃癌和食道癌的临床一 / 二期研发阶段和治疗鼻咽癌和非小细胞肺癌的临床一期研发阶段。
2020年2月25日,该药的IND申请获得国家药品监督管理局(NMPA)承办,为化药一类。2020年4月,该药获得NMPA临床默示许可,与CS1001注射液联合治疗晚期肝细胞癌、头颈部鳞状细胞癌、子宫内膜癌等晚期实体瘤。
13. 甲磺酸哆希替尼片
甲磺酸哆希替尼是由河南真实生物科技开发的一种EGFR抑制剂。2020年3月3日,该药的IND申请获得国家药品监督管理局(NMPA)承办,为化药一类。2020年4月,该药获得NMPA临床默示许可,用于治疗非小细胞肺癌(IIIB/IIIC或IV期的局部或转移性肺癌)。
1类生物药临床审批概况
2020年4月,共有13个中国1类治疗用生物制品获得国家药品监督管理局(NMPA)的临床试验默示许可,具体信息如下表所示:
1. GC007g注射液
GC007g是由亘喜生物科技研发的Donor CAR-19细胞疗法。2020年1月,该药的IND申请获得NMPA承办,为治疗用生物制品一类。2020年4月,该药获得NMPA临床试验默示许可,用于治疗异基因移植后复发难治性CD19阳性急性B淋巴细胞白血病。
2. 注射用卡瑞利珠单抗
卡瑞利珠单抗(SHR-1210)是由江苏恒瑞研发的一种靶向于程序性细胞死亡因子1(PD-1)的人源化单克隆抗体,该药由江苏恒瑞有限公司研发,于2019年5月29日获国家药品监督管理局(NMPA)批准上市,商品名为艾瑞卡?,用于治疗既往接受过至少二线系统性治疗的复发/难治性经典型霍奇金淋巴瘤(cHL)患者。
2020年1月16日,该药一项IND申请获得国家药品监督管理局(NMPA)承办,为治疗用生物制品一类。2020年4月,分别获得NMPA临床试验默示许可,注射用卡瑞利珠单抗拟联合甲磺酸阿帕替尼对比紫杉醇或伊立替康治疗一线化疗失败的晚期胃或胃食管结合部腺癌患者。
3. 重组人源化抗PD-1单克隆抗体注射液
中山康方生物医药、泰州翰中生物医药有限公司和杭州翰思生物医药有限公司联合开发的重组人源化抗PD-1单抗(AK-103、HX-008)拟用于治疗多种实体瘤,包括黑色素瘤、肺癌、肾癌、膀胱癌、晚期或转移性胃癌(包括胃食管交界癌)等,目前对晚期胃癌和黑色素瘤以及微卫星高度不稳性获基因错配修复缺陷晚期实体瘤处于临床二期阶段。
研发里程碑
2020年2月,该药的IND申请获得NMPA承办,为治疗用生物制品一类。2020年4月,该药获得NMPA临床默示许可,重组人源化抗PD-1单克隆抗体注射液与LP002注射液联合用于治疗既往经抗PD-1或PD-L1单抗治疗出现疾病进展的局部进展或转移性的黑色素瘤。
2020年1月,该药的IND申请获得NMPA承办,为治疗用生物制品一类。2020年4月,该药获得NMPA临床试验默示许可,重组人GM-CSF溶瘤II型单纯疱疹病毒(OH2)注射液联合重组人源化抗PD-1单克隆抗体注射液用于不可手术切除,标准治疗失败的晚期实体瘤(如乳腺癌、黑色素瘤、头颈癌、软组织肉瘤、肝癌或肝转移瘤等)的治疗。
2019年4月,治疗恶性实体瘤(胃肠癌,头颈癌,软组织肉瘤)的临床一期试验开始(NCT03866525)。
2018年10月,在标准治疗失败后的局部进展或转移性黑色素瘤患者(n = 122)中进行的单臂、非随机、开放II期临床试验(CTR20181881)计划在中国启动,显示尚未招募。
2018年9月,一项多中心、开放、单组分配临床II期研究(NCT03704246)在中国启动,主要评估HX-008与伊立替康联用的疗效,涉及两个队列,即晚期胃腺癌患者和一线化疗治疗失败的局部晚期或转移性胃腺癌以及微卫星高度不稳定或基因错配修复缺陷晚期实体瘤患者,主要研究终点为ORR,当时预计将于2020年3月完成。
2018年8月,HX008注射液与卡培他滨和奥沙利铂联合用于治疗晚期胃癌的临床二期研究(CTR20181270)已在中国进行,显示招募中。
2018年8月,HX008 注射液治疗晚期实体瘤的多中心、开放、II 期临床研究(CTR20181269)已在中国开展,显示招募中,针对经一线化疗失败后的局部晚期或转移性胃腺癌以及微卫星高度不稳定或基因错配修复缺陷晚期实体瘤患者。
2018年1月,评估AK-103在局部晚期或转移性实体瘤患者中安全性、耐受性,且确定MTD和RP2D的I期临床试验(CTR20180125)在中国启动。
2017年2月,在中国的新药临床试验(IND)申请获CDE受理,由中山康方生物医药有限公司、泰州翰中生物医药有限公司、杭州翰思生物医药有限公司联合申报,并于2017年9月获得了临床批件。
融资及交易
2018年11月,与和记黄埔医药达成在在中国的合作协议,开始在实体瘤中开发HX008与索凡替尼联用。
4. TST001注射液
TST001是一种人源化的高亲和力抗 CLDN18.2 抗体,由迈博斯生物公司与奕安济世生物药业合作研发,处于治疗实体瘤、胃食管交界处腺癌、胆道癌、胆囊癌和肺癌的临床一期。
TST001可通过抗体依赖性细胞** (ADCC) 杀死肿瘤细胞,对于有CLDN18.2低表达的肿瘤细胞,Claudin18.2人源化单克隆抗体的ADCC活性可以提高100倍以上。在临床前研究中,TST001 在多种肿瘤动物模型中显示有效,并且在GLP毒理学研究中具有良好的耐受性。
研发里程碑
2020年4月,TST001获得美国食品药品监督管理局 (FDA)的临床试验批准,用于治疗癌症。
2020年4月,该药获得NMPA临床试验默示许可,单药或联合标准治疗用于治疗Claudin18.2表达阳性的晚期实体瘤,包括但不限于胃/胃食管结合部腺癌,胰 腺导管腺癌,胆管癌,胆囊癌,肺腺癌等。
2020年1月,该药的IND申请获得NMPA承办,为治疗用生物制品一类。
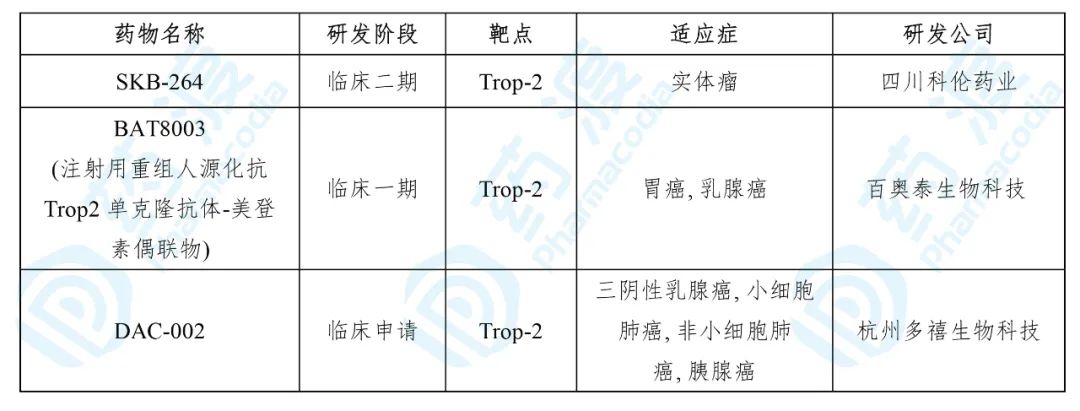
5. 注射用SKB264
SKB-264是Klus Pharma(四川科伦药业的子公司)开发的一种靶向表达TROP2的癌细胞的抗体药物偶联物(ADC),目前处于治疗实体瘤的临床一/二期研究。
研发里程碑
2020年1月21日,该药的IND申请获得国家药品监督管理局(NMPA)承办,为治疗用生物制品一类。2020年4月,该药获得NMPA临床试验默示许可,拟用于实体瘤的治疗。
2019年10月,公布治疗实体瘤的临床一/二期试验,例如卵巢上皮癌,胃腺癌,胰 腺腺癌,三阴性乳腺癌和膀胱癌,实验预计在2019年12月开始(NCT04152499)。
目前靶向Trop-2的中国1类药物如下表所示:
6. BJ-001注射液
BJ-001是博际生物医药自主研发并拥有全球专利的世界首个肿瘤靶向性IL-15融合蛋白,处于治疗实体瘤一期临床研究和感染类疾病的临床前研究。 IL-15是一种多效能性细胞因子,所以在肿瘤和感染性疾病领域都有较高的治疗潜力。BJ-001不仅克服了重组IL-15半衰期短的缺点,更重要的是其肿瘤靶向性可以使IL-15在靶点高表达的肿瘤中富集,从而起到降低系统**,增强疗效的作用。
2020年1月21日,该药的IND申请获得国家药品监督管理局(NMPA)承办,为治疗用生物制品一类。2020年4月,该药获得NMPA临床试验默示许可,用于治疗局部晚期或转移实体瘤。
7. 人脐带间充质干细胞注射液
人脐带间充质干细胞由贝来生物研发。2020年1月,该药的IND申请获得NMPA承办,为治疗用生物制品一类。2020年4月,该药获得NMPA临床试验默示许可,用于治疗类风湿关节炎。
8. 重组人GM-CSF溶瘤II型单纯疱疹病毒(OH2)注射液(Vero细胞)
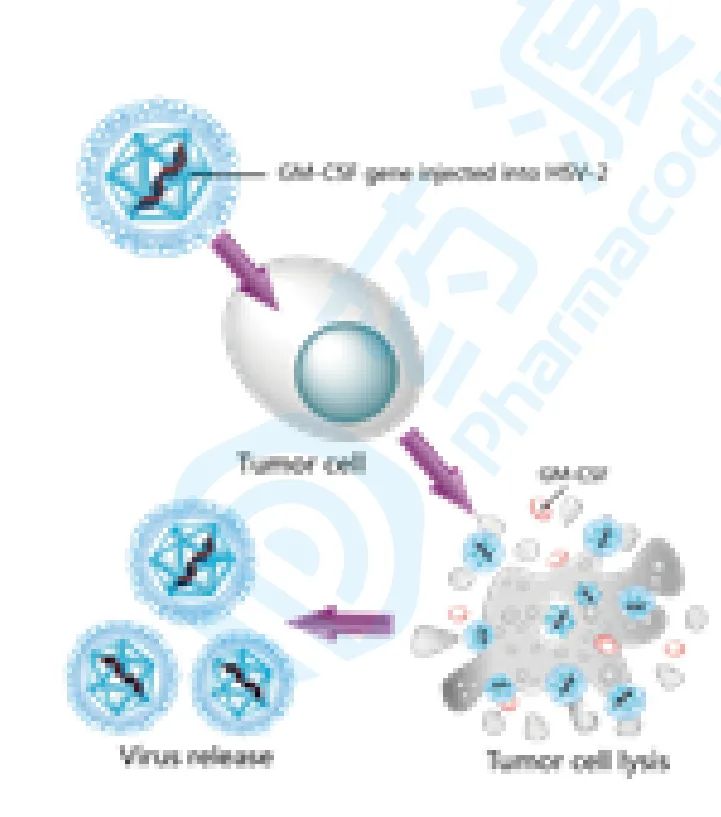
武汉滨会生物开发的重组人GM-CSF溶瘤II型单纯疱疹病毒(OH2)注射液(Vero细胞),主要用于治疗对实体瘤,包括肺癌、头颈部肿瘤、淋巴瘤、肝癌、黑色素瘤等。
研发里程碑
2020年1月22日,该药的IND申请获得国家药品监督管理局(NMPA)承办,为治疗用生物制品一类;2020年4月,该药获得NMPA临床试验默示许可,重组人GM-CSF溶瘤II型单纯疱疹病毒(OH2)注射液(Vero细胞)联合重组人源化抗PD-1单克隆抗体注射液用于不可手术切除,标准治疗失败的晚期实体瘤(如乳腺癌、黑色素瘤、头颈癌、软组织肉瘤、肝癌或肝转移瘤等)的治疗。
2019年11月13日,该药的IND申请获得国家药品监督管理局(NMPA)承办,为治疗用生物制品一类;2020年2月获得临床试验默示许可,LP002注射液与重组人GM-CSF溶瘤II型单纯疱疹病毒(OH2)注射液(Vero细胞)联合拟用于治疗经标准治疗失败后、便于瘤内注射的晚期实体瘤(如乳腺癌、黑色素瘤、头颈癌、软组织肉瘤等)。
2018年12月,对晚期实体瘤的开放、剂量递增I期临床试验(CTR20182222)已在中国开始。
2017年7月,该产品在中国的新药临床试验(IND)申请(治疗用生物制品1类)获CDE受理,并于2018年7月获得临床批件。
临床结果
2019年9月21日,在第四届中国医药创新与投资大会(CBIIC)公布的临床一期结果显示,OH2注射液安全性良好,研究者判断与药物可能有关的不良事件程度较轻,受试者均未出现剂量限制性**DLT;初步显示出良好的抗肿瘤效应,总体疾病控制率DCR为78%;受试者血液、唾液、尿和粪便中均未检出OH2病毒拷贝数。
融资及交易
2018年8月,武汉滨会生物完成1.1亿元的A轮融资,由乐普医疗控股子公司乐普生物独家领投。
2015年12月3日,武汉滨会生物科技股份有限公司取得全国中小板块股份转让系统(新三板)函告通知,获批挂牌新三板。
9. IM19嵌合抗原受体T细胞注射液
北京艺妙神州开发的IM19嵌合抗原受体T细胞(IM19CAR-T细胞)靶向于B淋巴细胞表面CD19,目前处于治疗白血病的临床一/二期研究,以及治疗其它血液恶性肿瘤(包括非霍奇金淋巴瘤)的临床一期试验阶段。
研发里程碑
2018年7月26日,该药的IND申请获得国家药品监督管理局(NMPA)承办,为治疗用生物制品一类。2020年4月,该药获得NMPA临床默示许可,用于治疗治疗复发或难治CD19阳性的非霍奇金淋巴瘤。
2018年5月,对复发或难治CD19阳性非霍奇金淋巴瘤的临床I期研究(NCT03528421)在中国开始。
2018年2月,应新的细胞治疗指导原则要求在中国提交的新药临床试验(IND)申请(治疗用生物制品1类)获CDE受理。2020年4月,该药获得NMPA临床默示许可,用于治疗复发或难治CD19阳性的急性B淋巴细胞白血病(B-ALL)。
2017年8月,对CD19阳性的B细胞恶性血管瘤患者中穹顶一项开放标签临床I期研究(NCT03344705)在中国开始,当时预计将于2020年12月完成。
2016年8月,在中国启动临床I期研究(NCT03142646)。
融资及交易
2018年1月,和铂医药与艺妙神州达成合作,以开发全人源单克隆抗体片段用于新一代嵌合抗原受体T细胞(CAR-T)细胞免疫治疗。
2017年11月23日,艺妙神州完成总额达5000万元融资,由君联资本领投,Thiel Capital和盛景网联跟投。
2016年3月,北京艺妙神州医疗科技有限公司获得数千万人民币的A轮融资,投资方为同创伟业、盛景网联(盛景嘉成)。
2015年12月,艺妙神州完成1000万人民币preA轮融资,投资方为盛景网联和首都科技集团。
2015年6月,艺妙神州拿到500万人民币的天使投资,由同创伟业领投、清华x-lab创业DNA基金跟投。
10. 靶向CD30嵌合抗原受体基因修饰的自体T细胞注射液
武汉波睿达生物科技有限公司开发的靶向CD30嵌合抗原受体T细胞疗法是一种免疫疗法,用于静脉注射治疗CD30阳性淋巴组织增生性疾病。
2020年1月22日,该药的IND申请获得国家药品监督管理局(NMPA)承办,为治疗用生物制品一类。2020年4月,该药获得NMPA临床试验默示许可,用于治疗18~70岁的CD30+复发/难治性血液肿瘤。
11. 重组抗PD-L1全人单克隆抗体注射液
CS1001由基石药业从美国Ligand公司授权引进的OMT转基因动物平台研发产生,为全人源全长的抗PD-L1单克隆抗体。其与人体自身天然G型免疫球蛋白4(IgG4)接近,因此可降低在患者体内产生免疫原性及相关**的风险。CS1001目前正在进行治疗复发或难治性经典型霍奇金淋巴瘤和复发或难治性结外自然杀伤细胞/T细胞淋巴瘤的临床二期试验,非小细胞肺癌(NSCLC)和胃腺癌或者胃食管结合部腺癌的研究已进入临床三期阶段。
2020年2月10日,该药的IND申请获得国家药品监督管理局(NMPA)承办,为治疗用生物制品一类。2020年4月,该药获得NMPA临床试验默示许可,联合甲苯磺酸多纳非尼(Donafenib)用于晚期实体瘤的治疗。
12. 注射用间充质干细胞(脐带)
天津昂赛细胞基因工程有限公司研发的脐带间充质干细胞注射液,2018年9月,在中国提交的IND申请(1类治疗用生物制品)获CDE受理。2020年4月,该药获得NMPA临床默示许可,用于治疗移植物抗宿主病。
13. LP002注射液
LP-002是泰州厚德奥科开发的靶向PD-L1的中国1类治疗用生物制品,目前处于治疗皮肤鳞状上皮细胞癌的临床二期试验阶段以及治疗晚期实体瘤和消化系统肿瘤的临床一期试验阶段。
研发里程碑
2020年2月15日,该药的IND申请获得国家药品监督管理局(NMPA)承办,为治疗用生物制品一类。2020年4月,该药获得NMPA临床默示许可,重组人源化抗PD-1单克隆抗体注射液与LP002注射液联合用于治疗既往经抗PD-1或PD-L1单抗治疗出现疾病进展的局部进展或转移性的黑色素瘤。
2019年11月20日,该药的IND申请获得国家药品监督管理局(NMPA)承办,为治疗用生物制品一类。2020年2月,获得临床试验默示许可,LP002与重组人GM-CSF溶瘤II型单纯疱疹病毒(OH2)注射液(Vero细胞)联合拟用于治疗经标准治疗失败后、便于瘤内注射的晚期实体瘤(如乳腺癌、黑色素瘤、头颈癌、软组织肉瘤等)。
2018年6月,新药临床试验(IND)申请(治疗用生物制品1类)获得CDE受理,并于2018年9月获得临床批件。
中国1类新药NDA/BLA申请概况
2020年4月,国家药品监督管理局(NMPA)药审中心共承办了2个中国1类生物药的BLA申请,具体信息如下表所示:
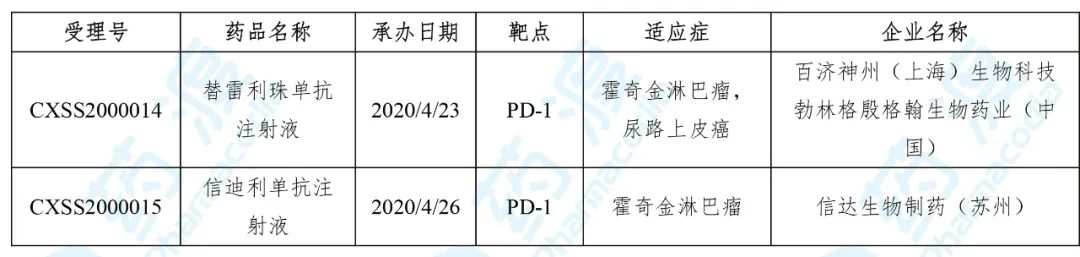
1. 替雷利珠单抗注射液
替雷利珠单抗已经于2019年12月27日获得国家药品监督管理局(NMPA)批准,由百济神州研发并上市销售,商品名为百泽安® 。
替雷利珠单抗是一种靶向于程序性死亡受体1(PD-1)的IgG4型单克隆抗体,能与T细胞表面的PD-1结合,阻断癌细胞通过PD-1对T细胞的免疫抑制作用。本品被批准用于接受过至少两种既往治疗的复发或难治性经典型霍奇金淋巴瘤,以及用于治疗接受含铂化疗失败包括新辅助或辅助化疗12个月内进展的局部晚期或转移性PD-L1高表达的尿路上皮癌(UC)患者。
2020年4月23日,替雷利珠单抗再次向NMPA提交了新药上市申请,用于联合两项化疗方案治疗一线晚期鳞状非小细胞肺癌(NSCLC)患者。
2. 信迪利单抗注射液
信迪利单抗(IBI-308)是信达生物开发的一种全人源单克隆抗体,靶向于程序性死亡受体1(PD-1),通过阻断体内PD-1与配体PD-L1之间的结合,使T细胞发挥正常作用,进而利用自身免疫清除肿瘤细胞。信迪利单抗用于至少经过二线系统化疗的复发或难治性经典型霍奇金淋巴瘤的治疗于2018年12月24日获NMPA批准上市,商品名为达伯舒® (Tyvyt® ),此外,治疗晚期的或转移性鳞状非小细胞肺癌、胃及胃食管交界处腺癌的研究,现处于临床III期。
2020年4月26日,信迪利单抗再次向NMPA提交了新药上市申请,用于非鳞状非小细胞肺癌(nsqNSCLC)一线治疗。



合作咨询
![]() 肖女士
肖女士
![]() 021-33392297
021-33392297
![]() Kelly.Xiao@imsinoexpo.com
Kelly.Xiao@imsinoexpo.com
 2006-2025 上海博华国际展览有限公司版权所有(保留一切权利)
沪ICP备05034851号-57
2006-2025 上海博华国际展览有限公司版权所有(保留一切权利)
沪ICP备05034851号-57