近日,中国生物制药子公司北京泰德制药的利马前列素片拟纳入优先审评,该产品的原研企业为日本小野制药,目前该产品在国内暂无原研或仿制上市,早前恒瑞医药的临床申请已获批,目前仅有北京泰德制药的上市申请在审评审评中。
图1:利马前列素片的详细情况

来源:CDE官网
据悉,利马前列素是一种人工合成的前列腺素E1衍生物。由于消化系统酶的破坏,传统的前列腺素类药物易被分解代谢,一般口服无效,利马前列素具有特殊的结构,口服可以发挥药理作用,提高了临床的适应性,是最早用于循环系统的口服前列腺素类药物。米内网跨国上市公司销售数据库数据显示,2018年日本小野制药的利马前列素片全球销售额达104亿日元(约1亿美元)。
表1:利马前列素片注册申请情况
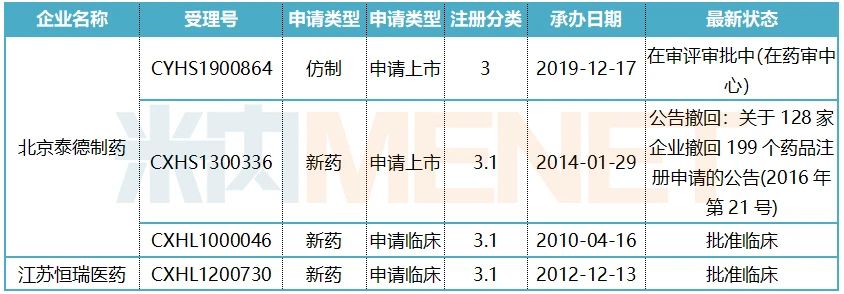
来源:米内网MED中国药品审评数据库2.0
米内网数据显示,目前利马前列素片国内获批临床的药企有北京泰德制药和江苏恒瑞医药。北京泰德制药在2012年获批临床,2014年申报上市后撤回,本次拟纳入优先审评的理由为“列入《关于开展药物临床试验数据自查核查工作的公告》(国家食品药品监督管理总局公告2015年第117号)的自查核查项目,申请人主动撤回并改为按与原研药质量和疗效一致的标准完善后重新申报的仿制药注册申请”。恒瑞医药在2015年获批临床后暂无最新申报上市的消息,从目前情况来看,利马前列素片首仿归入中国生物制药手中的几率较大。
来源:公司公告、米内网数据
注:审评数据统计截至2020年4月30日,如有错漏敬请指正。



合作咨询
![]() 肖女士
肖女士
![]() 021-33392297
021-33392297
![]() Kelly.Xiao@imsinoexpo.com
Kelly.Xiao@imsinoexpo.com
 2006-2025 上海博华国际展览有限公司版权所有(保留一切权利)
沪ICP备05034851号-57
2006-2025 上海博华国际展览有限公司版权所有(保留一切权利)
沪ICP备05034851号-57