鉴于硼与碳、氮(构成生命主链的两个必需原子)位于同一周期,以及硼原子中心易于从中性三角平面sp2杂交变成四面体sp3杂交等化学性质,其在药物设计中能发挥重要作用。
图1:含硼基团,图片来源于参考文献1
自1990年代后期以来,无论是化学合成,生物研究还是药物研究,基于硼的小分子在文献中越来越多地出现[1, 2]。自2003年起,FDA已经批准了5种含硼药物上市销售[3]。下面将一一详述。
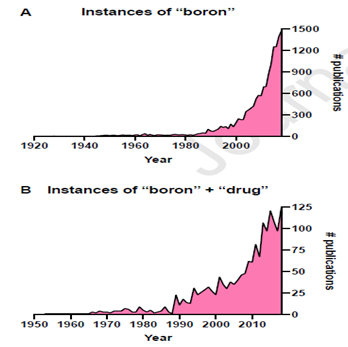
图2:文献中与硼有关的小分子化合物数量增长情况,图片来源参考文献1
1 Bortezomib(硼替佐米,商品名Vlecade®)
Bortezomib最初于1995年在Myogenics合成。然后,该药物进行了一项针对多发性骨髓瘤患者的小型I期临床试验。1999年10月由Millennium Pharmaceuticals进行了进一步的临床试验。2003年5月经FDA批准用于多发性骨髓瘤治疗。
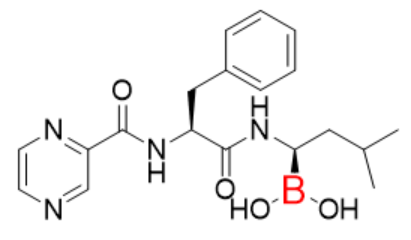
图3:Bortezomib分子结构式
作用机理
在正常细胞中,蛋白酶体会参与泛素化蛋白质的降解。但是,在癌细胞中,蛋白酶体会降解癌细胞中的促凋亡蛋白,例如p53。硼替佐米中的硼原子则通过特异性催化结合26S蛋白酶体的活性位点来抑制蛋白酶体活性,使得癌细胞中的促凋亡蛋白不会被降解,进而导致细胞周期停滞和凋亡。
药物代谢
皮下给药后,血浆峰值水平为~25-50nM,并持续1-2小时。而静脉注射后,血浆峰值水平约为500nM,但仅持续约5分钟,之后分布到组织的药物浓度迅速下降(分布容积约为500L)。另外,硼替佐米主要通过细胞色素P450酶3A4、2C19和1A2氧化代谢,而不会通过CYP2D6和2C9酶代谢。晚期恶性肿瘤患者服用剂量为1.45至2.00mg/m2硼替佐米后的平均消除半衰期为9至15h,并通过肝 脏代谢清除。
关键临床数据
此药物获批是基于国际、随机、双盲的II期和III期临床试验的结果。两项开放性II期临床试验(SUMMIT和CREST)确定了硼替佐米1.3 mg/m2在21天周期的第1, 4, 8和11天给予静脉推注的疗效,并有效延长了重度预治疗的复发/难治性多发性骨髓瘤患者的生命周期。III期APEX试验则证明硼替佐米1.3 mg/m2优于高剂量地塞米松方案(例如中位TTP 6.2 vs 3.5个月,1年生存率80% vs 66%)[4]。
2 Ixazomib (依沙佐米, 商品名Ninlaro®)
Ixazomib是由日本武田公司研发的第二代蛋白酶体抑制剂,于2015年11月经FDA批准,作为首个口服药物用于多发性骨髓瘤治疗并结合其他2种疗法(来那度胺和地塞米松)用于至少接受过1种既往疗法的患者。在控制骨髓瘤生长和预防骨丢失方面,与硼替佐米具有相同的功效。
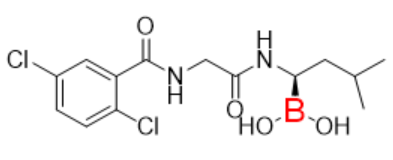
图4:Ixazomib分子式
作用机理
Ixazomib是一种二肽基亮氨酸硼酸,可逆地抑制20S蛋白酶体的CT-L蛋白水解(β5)位点。更高浓度的Ixazomib也能抑制蛋白水解性β1和β2亚基并诱导泛素化蛋白的积累。
药物代谢
口服给药后,达到血浆最大浓度的时间为1h,平均绝对生物利用度为58%。Ixazomib主要是通过CYP和非CYP途径代谢,而CYP同工酶不参与其代谢。Ixazomib在高于临床浓度时被多种CYP亚型代谢比例分别为3A4(42%),1A2(26%),2B6(16%),2C8(6%),2D6(5%),2C19(5%)和2C9(<1%)。此外,该药物主要经肾 脏清除,且终端半衰期为9.5天。
关键临床数据
该药物获批主要是基于一项国际、随机、双盲的III期临床试验的结果。该试验共纳入722例多发性骨髓瘤复发患者。受试者分别接受依沙佐米+来那度胺+地塞米松和安慰剂+来那度胺+地塞米松治疗。试验取得了较好的疗效和安全性,明显延长了患者的无进展生存期(Progression Free Survival,PFS)。与服用安慰剂的患者相比,服用了依沙佐米的患者的无疾病恶化期更长,分别为14.7个月和20.6个月,且不良事件发生率相比硼替佐米明显降低[5]。
3 Tavaborole (他伐硼罗,商品名Kerydin®)
Tavaborole是Anacor公司首个基于硼的局部用抗真菌药物,于2014 年 7 月 7 日经FDA批准用于局部治疗趾甲真菌感染。Anacor专注于基于硼元素的药物的研发和生产,根据其最新的消息,Tavaborole未来也可用于手指甲感染。
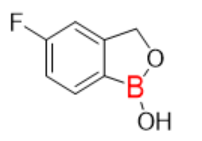
图5:Tavaborole分子式
作用机理
Tavaborole通过与细胞质亮氨酰氨酰基转移RNA(tRNA)合成酶形成加合物来阻止细胞蛋白质合成,从而发挥其抗真菌活性。
药物代谢
单次给药后,Tavaborole的平均峰值浓度(Cmax)为3.54±2.26 ng/mL),平均AUClast为44.4±25.5 nghr/mL。每日给药, 2周后,平均Cmax为5.17±3.47 ng/mL,平均AUCτ为75.8±44.5 nghr/mL。此外,Tavaborole经局部给药5天后显示出抗真菌作用,半衰期为 28.5h,而且主要通过肾 脏清除代谢产生的硫酸盐结合物和苯甲酸代谢物。
关键临床数据
FDA 是基于两项共纳入1194例患者的多中心、随机、双盲临床试验确定Tavaborole的有效性和安全性。临床试验将Tavaborole与含有活性护肤品成分的局部赋形剂相对比。主要终点为“完全治愈”,定义为趾甲完全干净(0% 的临床病变),同时KOH测试及培养阴性确定真菌感染治愈。在两个试验中,完全治愈的比例分别6.5% 和9.1%,各自使用赋形剂的对照组完全治愈的比例为0.5%和1.5%。次要终点为“完全或接近完全治愈”,即真菌感染治愈的同时临床病变小于10%,或者仅有真菌感染的治愈。在这两方面Tavaborole均表现出明显优势。Tavaborole通常具有良好的耐受性,据报道大多数不良事件为轻度且与治疗无关。超过1% 的参与者发生的与治疗相关的不良事件包括应用部位剥落,应用部位红斑和应用部位皮炎以及趾甲向内生长[5, 6]。
4 Crisaborole(克立硼罗, 商品名Eucrisa®)
Crisaborole于2016年12月14日经FDA批准为一种轻度至中度特应性皮炎的局部治疗药物。其结构包含一个硼原子,该硼原子有助于皮肤渗透并与磷酸二酯酶4(PDE4)的双金属中心结合。此外,该药物目前正在开发作为牛皮癣的局部治疗方法。
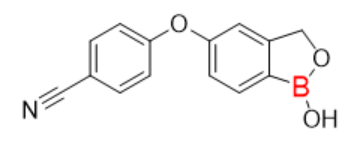
图6:Crisaborole分子式
作用机理
Crisaborole对磷酸二酯酶4 (PDE4)的抑制作用导致环状单磷酸腺苷(cAMP)含量升高。细胞内cAMP水平的升高会抑制NF-kB通路并抑制促炎性介质(如TNF-α和各种白介素)的释放,从而治疗特应性皮炎和牛皮癣。
药物代谢
Crisaborole与人类血浆蛋白的结合率为97% 并被代谢为5-(4-氰基苯氧基)-2-羟基苄醇(代谢产物1)和5-(4-氰基苯氧基)-2-羟基苯甲酸(代谢产物2)。肾 脏排出代谢物是Crisaborole主要的清除途径。
关键临床数据
该药物获批是基于一项多中心、开放性的长达48周的长期安全性研究的临床试验结果(AD-303)。在关键研究和AD-303期间,65% 的患者报告了≥1级的不良事件(TEAE),其中大部分为轻度(51.2%)或中度(44.6%),和与治疗无关者(93.1%)。TEAE出现的频率和严重程度是一致的。最常见的与治疗相关的不良反应(总体为10.2%)是过敏性皮炎(3.1%)、应用部位疼痛(2.3%)和应用部位感染(1.2%)。九例患者(1.7%)因为TEAE停止了该药物的长期研究。试验结果表明使用Crisaborole软膏48周治疗特应性皮炎患者,造成的相关不良事件发生率很低[5-7]。
5 Vaborbactam-Meropenem (美罗培南-法硼巴坦, 商品名Vabomere®)
Vabomere是基于环状硼酸药效团的β-内酰胺酶抑制剂,由Vaborbactam和Meropenem组成。它已被用于不同程度的肾功能不全患者的细菌感染治疗试验中。2017年8月, FDA批准Vabomere用于治疗患有复杂尿路感染(cUTI)的成年患者。
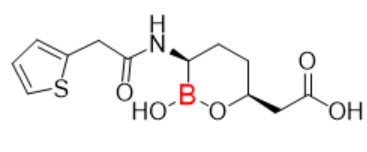
图7:Vabomere分子式
作用机理
Vabomere则是一种环状硼酸药效团β-内酰胺酶抑制剂,可有效抑制肺炎克雷伯菌酶(KPC)以及其他Ambler A类(CTX-M,SHV,TEM)和C类(P99,MIR,FOX)酶(例如丝氨酸β-内酰胺酶)。对D类或B类碳青霉烯酶没有抑制作用。另外, 与美罗培南组合使用时,Vabomere充当非自杀性β-内酰胺酶抑制剂,可保护美罗培南免受丝氨酸β-内酰胺酶(如肺炎克雷伯菌酶,KPC)降解。
药物代谢
在健康成人受试者中,多次输注2g剂量Vabomere后的Cmax为55.6 mg/L,AUC为588 mg?h/L,半衰期为1.68 h。在相同给药方案下,稳定状态下的Cmax为71.3 mg/L,AUC为835 mg?h/L。反复给药后,Vabomere的Cmax和AUC暴露量不会改变,并且不会在血浆中蓄积。Vabomere的平均血清蛋白结合率约为33%。此外,该药物主要经肾 脏清除,其中约75至95%的剂量在24至48h内从尿液排泄。
关键临床数据
此次获批是基于一项国际、随机、双盲的III期临床试验结果。该试验招募545人,平均年龄52.8岁,女性占66.2%,93.2%的患者完成研究。研究发现,美罗培南-Vaborbactam治疗组98.4%的患者达到主要终点,哌拉西林-他佐巴坦组94.0%的患者达到主要终点。治疗意向人群中,致病微生物根除率,美罗培南-Vaborbactamvs哌拉西林-他佐巴坦为66.7% vs 57.7%,差异为9%;致病微生物评估人群中,致病微生物根除率,美罗培南-Vaborbactamvs哌拉西林-他佐巴坦为66.3% vs 60.4%,差异为5.9%。不良事件率,美罗培南-Vaborbactamvs哌拉西林-他佐巴坦为39.0% vs 35.5%[8]。
小结
在药物发现方面,近年来将硼掺入药物化学研究中的趋势正在稳定增长。到目前为止,FDA已批准了五种含硼药物,其他几项正在临床试验中。含硼药物具有多种期望的性质,导致它们的使用增加,包括潜在地增强药物的效力和改善其药代动力学特性。对含硼的药物探索有望阐明硼掺入的优势,并鼓励医学和药物化学家将含硼化合物视为其药物发现计划中的可能性和解决方案。
相关参考文献
[1] Jessica Plescia et al. Design and discovery ofboronic acid drugs. European Journal of Medicine Chemistry.
[2] Guilherme Felipe Santos Fernandes et al. Boron indrug design: Recent advances in the development of new therapeutic agents. European Journal of Medicine Chemistry.
[3] DrugBank. https://www.drugbank.ca/
[4] www. dxye.com
[5] ClinicalTrials.gov
[5] FDA官网. https://www.accessdata.fda.gov/
[6] 丁香园. http://infect.dxy.cn/article/80411
[7] 药渡. https://www.pharmacodia.com/
[8] Keith S. Kaye et al. Effect of Meropenem-Vaborbactam vsPiperacillin-Tazobactam on Clinical Cure or Improvement and Microbial Eradication in Complicated Urinary Tract Infection The TANGO I RandomizedClinical Trial. JAMA.



合作咨询
![]() 肖女士
肖女士
![]() 021-33392297
021-33392297
![]() Kelly.Xiao@imsinoexpo.com
Kelly.Xiao@imsinoexpo.com
 2006-2025 上海博华国际展览有限公司版权所有(保留一切权利)
沪ICP备05034851号-57
2006-2025 上海博华国际展览有限公司版权所有(保留一切权利)
沪ICP备05034851号-57