2020年5月14日,国家药监局发布《关于开展化学药品注射剂仿制药质量和疗效一致性评价工作的公告》,CDE配套发布《化学药品注射剂仿制药质量和疗效一致性评价技术要求》、《化学药品注射剂(特殊注射剂)仿制药质量和疗效一致性评价技术要求》、《化学药品注射剂仿制药质量和疗效一致性评价申报资料要求》,至此业内期待已久的注射剂一致性评价正式启动,在4+7大背景下,一致性评价必将成为仿制药竞争格局重构的分水岭,行业竞争将继续加剧,重新洗牌已不可避免。
此次公告特别明确除氯化钠注射液、葡萄糖注射液、葡萄糖氯化钠注射液、注射用水、部分**药物等品种无需开展一致性评价之外,已上市的化学药品注射剂仿制药,未按照与原研药品质量和疗效一致原则审批的品种均需开展一致性评价。
据CDE数据库统计, 截止目前,已有160多个注射剂品种已有企业递交一致性评价补充申请,涉及150多家企业。其中,盐酸氨溴索注射液、注射用头孢曲松钠、注射用奥美拉唑钠、注射用帕瑞昔布钠、注射用头孢他啶已经有超过10家企业递交补充申请,成为注射剂一致性评价里面的最为热门品种。其中,已有41个品规注射剂通过/视同通过仿制药一致性评价。
据国内样本医院数据统计,2018年,中国公立医疗机构终端整体市场用药金额为2284亿元,其中注射剂用药金额为1406亿元,占61.6%;片剂用药金额为515亿元,占22.6%;胶囊剂用药金额为154亿元,占6.7%;其它剂型用药金额为208亿元,占9.1%。由此来看,注射剂在我国样本医院占比超过六成,注射剂一致性评价未来将成为仿制药企业竞争的主战场。
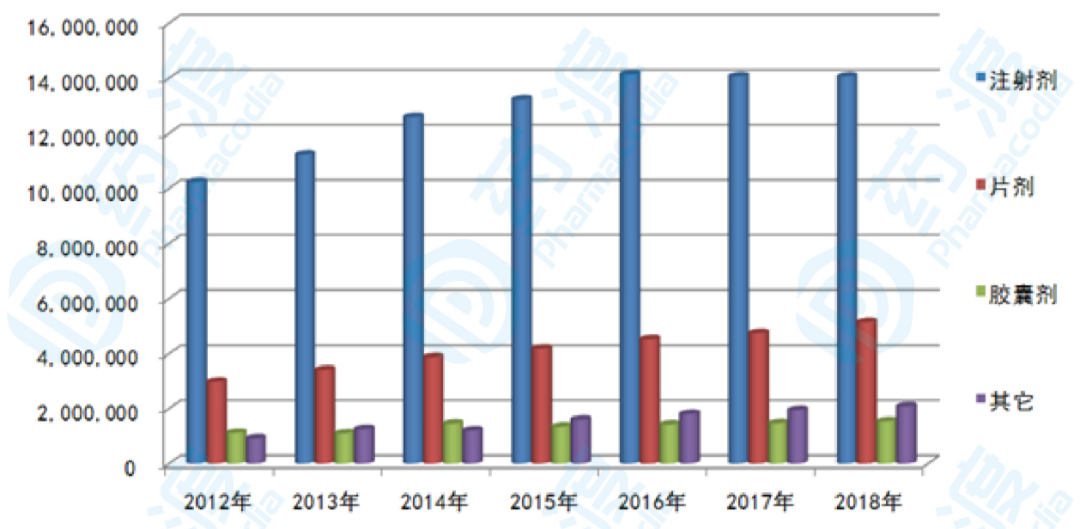
图1:2012-2018年国内样本医院各类剂型销售态势(单位:万元)
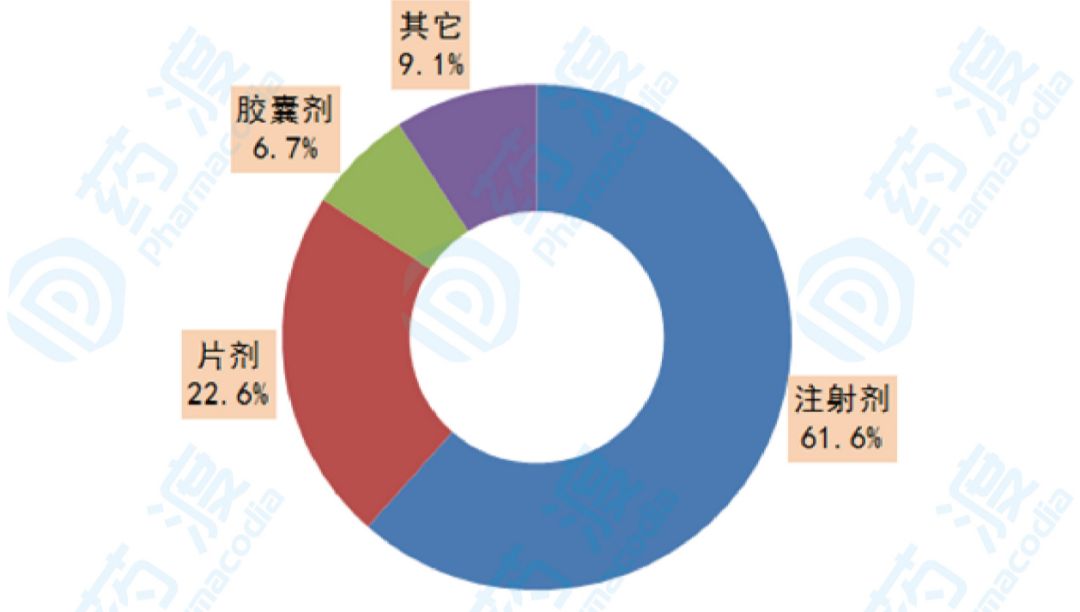
图2:2018年国内样本医院各类剂型占比
我国化药注射剂市场规模巨大,近年来,注射剂一致性评价一直是行业的热门话题,此前国家也陆续出台了相关文件,本次注射剂一致性评价正式文件出台,行业格局面临巨变。这对许多早就在谋划布局的注射剂一致性评价企业来讲,即是一副助推剂,同时也必将激发企业对化药注射剂一致性评价的紧迫感。
注射剂政策逐步推进
注射剂再评价是国内药企业关注的热点,同时也是国内医药企业角逐的主战场。国家在政策层面已经多次发文。本次公布公告,对注射剂一致性评价具有重要的指导意义。在国内医药市场中,相比口服固体制剂,注射剂品种具有市场空间更大、目前注射剂一致性评价已过评企业竞争较为缓和,随着政策的正式出台,未来注射剂一致性评价将成为企业快速抢占市场竞争的焦点。
2017年10月
两办发布《关于深化审评审批制度改革鼓励药品医疗器械创新的意见》,明确提出,根据药品科学进步情况,对已上市药品注射剂进行再评价,力争用5至10年左右时间基本完成。
2017年12月
药审中心发布《已上市化学仿制药(注射剂)一致性评价技术要求(征求意见稿)》,对参比制剂选择、处方工艺、原辅包进行了要求,但仍然未明确具体参比制剂。注射剂一致性评价征求意见稿发布后,注射剂一致性评价申报数量俱增,注射剂一致性评价竞赛拉开序幕。
2018年3月
药审中心对《药物注射剂研发技术指导意见》公开征求意见。而从CDE发布的第21批参比制剂目录开始,第一次出现注射剂,到目前为止,共有600多个注射剂品规。这也预示着注射剂一致性评价工作正在不断加快步伐。
2019年10月
国家药监局发布《化学药品注射剂仿制药质量和疗效一致性评价技术要求(征求意见稿)》、《已上市化学药品注射剂仿制药质量和疗效一致性评价申报资料要求(征求意见稿)》,主要针对“参比制剂”、“处方工艺”、“原辅料”、“稳定性”、“质量研究与控制技术”、“特殊注射剂”、“改规格注射剂”、“无需一致性评价品种”以及“说明书”等内容出台相关技术要求(征求意见搞)。
2020年5月14日
国家药监局发布《国家药监局关于开展化学药品注射剂仿制药质量和疗效一致性评价工作的公告》,历经两年多的注射剂一致性评价征求意见稿终于落地,此次公告的发布,尤其三项要求的正式文件发布(两项技术要求和一项申报资料要求),标志着注射剂一致性评价正式启动。对于当下注射剂市场的争夺战,各大龙头企业正在紧锣密鼓地抓紧抢报及对未来市场深度布局。
注射剂评价将再提速
从注射剂品种申请一致性评价来看,注射剂相比于口服制剂,注射剂一致性评价的申报速度来得更加猛烈。目前申请/视同申请注射剂一致性评价的数量排名最为突出的药企分别是:科伦药业、齐鲁制药、扬子江药业、中国生物制药和恒瑞医药。本次等待已久的仿制药注射剂一致性评价大幕正式开启,意味着注射剂再评价将再提速。
表1:注射剂一致性评价申报重点企业品种情况
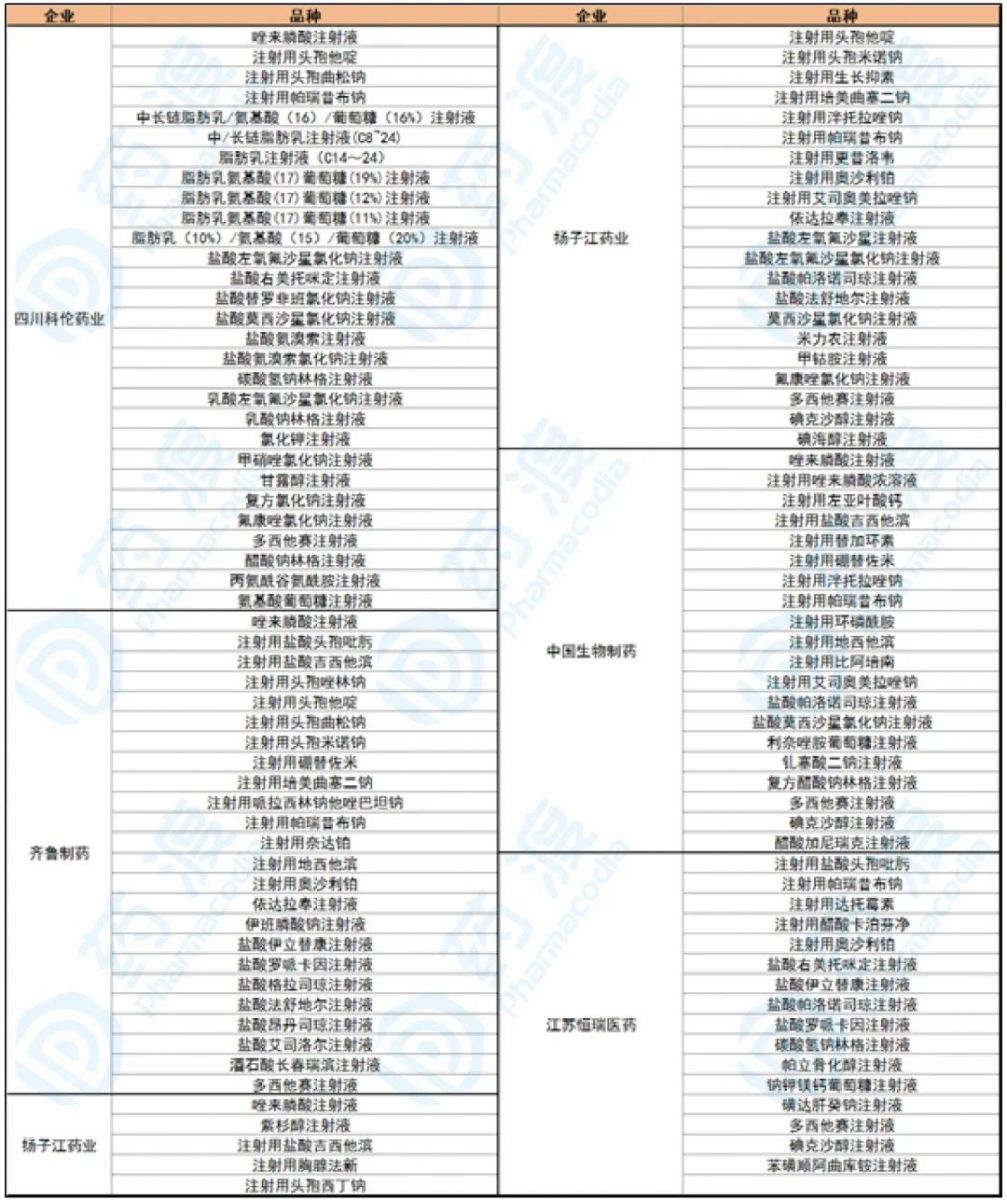
科伦药业 主要产品
注射用帕瑞昔布钠、盐酸氨溴索注射液、盐酸右美托咪定注射液、唑来膦酸注射液、氯化钾注射液、醋酸钠林格注射液、复方氯化钠注射液、甘露醇注射液、盐酸左氧氟沙星、氯化钠注射液、乳酸钠林格注射液、注射用头孢曲松钠、甲硝唑氯化钠注射液 、氟康唑氯化钠注射液、中/长链脂肪乳注射液、中长链脂肪乳/氨基酸/葡萄糖)注射液 、脂肪乳氨基酸等、脂肪乳注射液等。
齐鲁制药 主要产品
注射用培美曲塞二钠、多西他赛注射液、盐酸伊立替康注射液、注射用硼替佐米、注射用奥沙利铂、酒石酸长春瑞滨注射液、注射用地西他滨、注射用盐酸吉西他滨、盐酸昂丹司琼注射液、盐酸格拉司琼注射液、盐酸艾司洛尔注射液、盐酸罗哌卡因注射液、唑来膦酸注射液、依达拉奉注射液、注射用帕瑞昔布钠、盐酸法舒地尔注射液、注射用哌拉西林钠他唑巴坦钠、注射用头孢曲松、注射用盐酸头孢吡肟、注射用头孢他啶、注射用头孢唑林钠等。
正大天晴药业 主要产品
多西他赛注射液、注射用地西他滨、注射用硼替佐米、注射用环磷酰胺、注射用左亚叶酸钙、醋酸加尼瑞克注射液、注射用帕瑞昔布钠、注射用艾司奥美拉唑钠、注射用替加环素、复方醋酸钠林格注射液、注射用比阿培南等。
恒瑞医药 主要产品
多西他赛注射液、盐酸伊立替康注射液、注射用奥沙利铂、盐酸帕洛诺司琼注射液、盐酸右美托咪定注射液、苯磺顺阿曲库铵注射液、碘克沙醇注射液、注射用醋酸卡泊芬净、磺达肝癸钠注射液、注射用帕瑞昔布钠、碳酸氢钠林格注射液、盐酸罗哌卡因注射液、注射用盐酸头孢吡肟、钠钾镁钙葡萄糖注射液等。
扬子江药业 主要产品
紫杉醇注射液、注射用培美曲塞二钠、注射用奥沙利铂、注射用泮托拉唑钠、甲钴胺注射液、注射用头孢西丁钠、注射用头孢米诺钠、碘克沙醇注射液、碘海醇注射液、盐酸左氧氟沙星注射液、盐酸左氧氟沙星氯化钠注射液、氟康唑氯化钠注射液、盐酸法舒地尔注射液、依达拉奉注射液、注射用泮托拉唑钠、注射用生长抑素等。
由于我国注射剂市场庞大,企业参与注射剂一致性评价积极较高,可见,注射剂再评价是各企业必争的领域,从企业申报品种来看,注射剂一致性评价在近两年也呈快速增长态势。数据显示,随着越来越多的参比制剂发布,各大企业注射剂一致性评价工作正在提速,本次化药注射剂一致性评价必将带来巨大变量。从目前进行的一致性评价工作和各省挂网情况来看,未来几年注射剂或许将迎来一批淘汰。
注射剂过评品种实现弯道超车
目前CDE发布的参比制剂中涉及的注射剂品种受理号已超600个,已有150多个注射剂品种递交一致性评价补充申请,其中有41多个品规通过或视同通过一致性评价,主要涉及呼吸、血液、肿瘤、**、神经等多个用药领域。除普利制药的注射用阿奇霉素外,其余均为视同一致性评价。由于注射剂过评难度较大,目前注射剂一致性评价进展速度较慢。
表2:注射剂通过或视同通过一致性评价产品情况
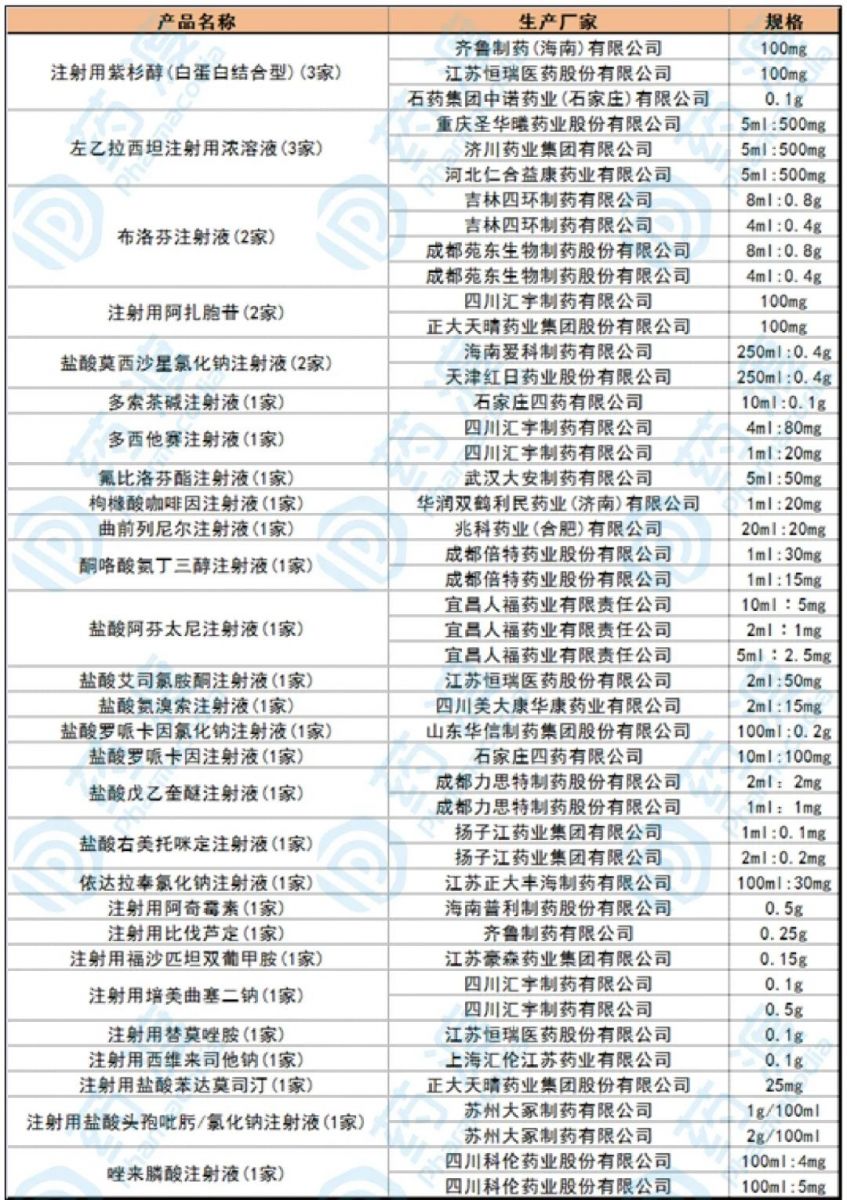
目前已通过仿制药一致性评价的注射剂,其中,注射用紫杉醇(白蛋白结合型)、左乙拉西坦注射用浓溶液各有3家企业通过,布洛芬注射液、注射用阿扎胞苷、盐酸莫西沙星氯化钠注射液各有2家企业通过,盐酸右美托咪定注射液、多西他赛注射液、依达拉奉氯化钠注射剂等品种各有1家通过。
当前,一致性评价竞争格局已成为带量采购大背景下,已成为决定仿制药品种格局的关键因素。按照全国集采品种过评要求,注射剂全面开展集采还为时尚早,因此此时开展注射剂一致性评也是大势所趋。在目前已过评的注射剂中,只有4个品种已经纳入国家带量采购,分别是右美托咪定注射液、注射用紫杉醇白蛋白、注射用培美曲塞二钠、氟比洛芬酯注射液。从竞争格局来看,除了注射用白蛋白紫杉醇有石药、恒瑞、齐鲁三家企业通过外,其他三个品种均为独家通过,目前注射剂通过或视同通过一致性评价品种竞争格局良好。
在已带量采购省份中,注射剂带量采购品种主要是在临床使用成熟、采购金额较大、竞争相对充分的品种。其中扬子江的右美托咪定注射液在4+7及扩围连续中标,跨国药企礼来的注射用培美曲塞二钠在4+7扩围时中标,注射用紫杉醇白蛋白同时由新基、石药和恒瑞3家在第二批带量采购时中标。
据国内样本医院数据统计,2019年,注射剂一致性评价通过重点产品:过30亿元以上的产品1个,为紫杉醇(包括注射用白蛋白紫杉醇)销售额为30.53亿元;在10-20亿元之间产品3个,分别是培美曲塞销售额为15.99亿元;多西他赛销售额为13.37亿元;分别是右美托咪定销售额为10.19亿元。其中扬子江药业盐酸右美托咪定注射液、四川汇宇制药注射用培美曲塞二钠在市场中实现了弯道超车。
2019年,右美托咪定国内用药金额达到10.19亿元,其中,江苏恒瑞医药销售额为5.2亿元,占据51%的市场份额;扬子江药业销售额为3.7亿元,占据36%的市场份额;江苏恩华药业销售额为7214万元,占据7%的市场份额;其它企业销售额为5601万元,占据5%的市场份额。第一批“4+7”带量采购实施一年后,2019年扬子江药业右美托咪定市占率快速提升,企业产品通过一致性评价是参与带量采购的入场券,也是快速提长升其市场份额的必要条件,同时也给了扬子江弯道超车的机会。
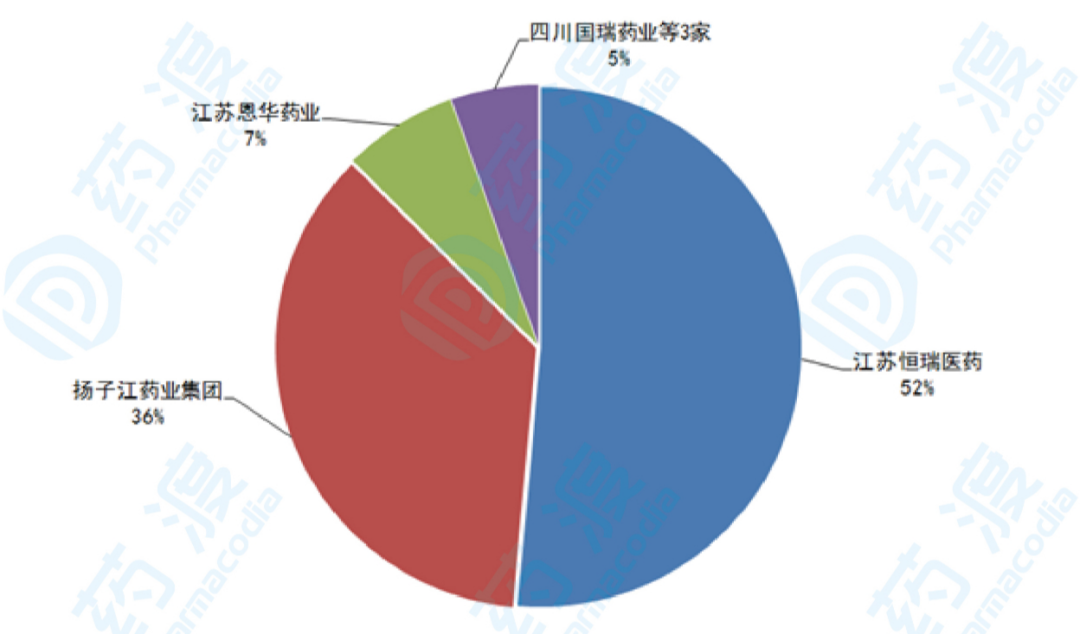
图3:2019年国内样本医院右美托咪定竞争格局
2019年,培美曲塞国内用药金额达到15.99亿元,其中,豪森药业销售额为6.08亿元,占据38.04%的市场份额;齐鲁制药销售额为3.60亿元,占据22.50%的市场份额;汇宇制药销售额为2.72亿元,占据17.03%的市场份额;其它企业销售额为3.59亿元,占据22.43%的市场份额。
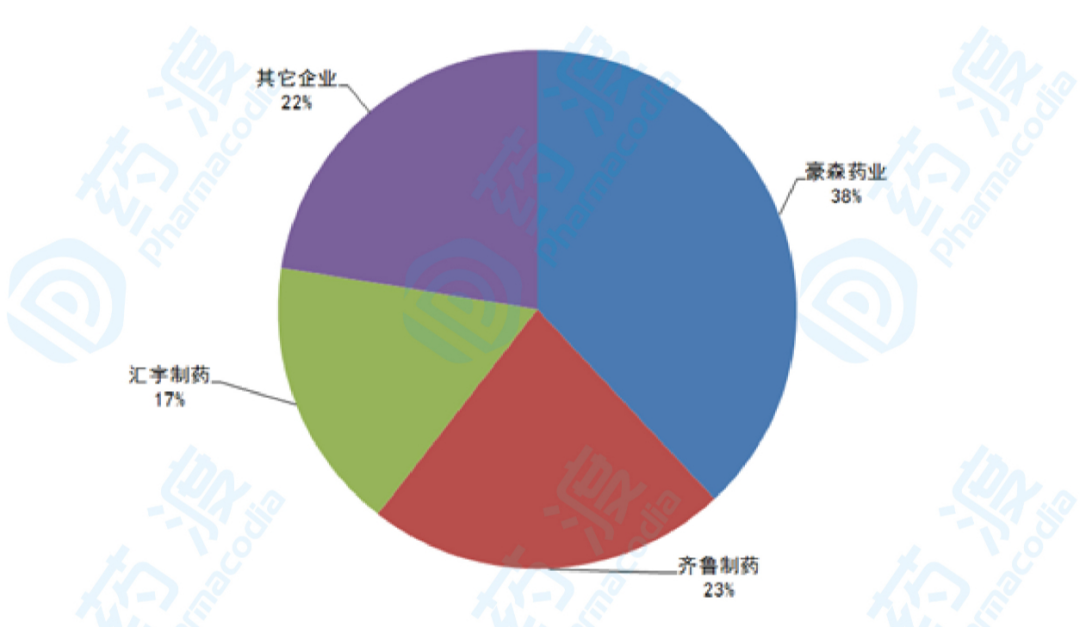
图4:2019年国内样本医院培美曲塞竞争格局
截止2020年5月,四川汇宇已有三大注射剂领跑过评榜,分别是注射用培美曲塞二钠、多西他赛注射液、注射用阿扎胞甘。在三款注射剂中,注射用培美曲塞二钠被纳入第一批4+7带量采购,作为该品种唯一过评企业,汇宇制药成功集采中标。在集采一年之后汇宇占据17.03%,汇宇制药借助带量采购销量迅速上升,抢占近20%市场份额,体现小企业在一致性评价和集采政策中的大智慧。
目前相比口服制剂的残酷竞争,注射剂市场竞争格局较为良好,中标价格下行压力相对较小。在当下注射剂市场的争夺鏖战中,各大重点龙头企业正在加紧深度布局,其中已进入集中采购的企业将未来市场中占据主动。
结语
近年来,随着注射剂一致性评价政策逐步明确、参比制剂不断公布以及新药注册法规鼓励创新药申报上市,化药注射剂市场受到不小的冲击,国内注射剂仿制药的质量水平有望逐步提升,注射剂一致性评价显然已驶入快车道。随着带量采购的执行及全国扩面,注射剂行业格局有望重构,同时也给许多企业带来新的市场机会,若企业能综合考虑市场情况进行合适的品种布局,将是一个弯道超车的好机会。总体来看,在国内注射剂这一主流战场中,一些有先见的细分领域龙头企业早已提前布局,这些企业在未来在激烈市场竞争中,将会占据更大优势。



合作咨询
![]() 肖女士
肖女士
![]() 021-33392297
021-33392297
![]() Kelly.Xiao@imsinoexpo.com
Kelly.Xiao@imsinoexpo.com
 2006-2025 上海博华国际展览有限公司版权所有(保留一切权利)
沪ICP备05034851号-57
2006-2025 上海博华国际展览有限公司版权所有(保留一切权利)
沪ICP备05034851号-57