暴风雨再次来临,2020年07月28日处罚因销售【性状】不符合规定的瓜蒌,并从中获利159.2元,被处罚金约110万的余波还未褪去。本次因生产记录造假,生产企业被罚约226万无疑又给了企业重重的一击。
有的网友直呼罚得好,有的网友直呼企业难!到底是好,还是难,且听且分析。
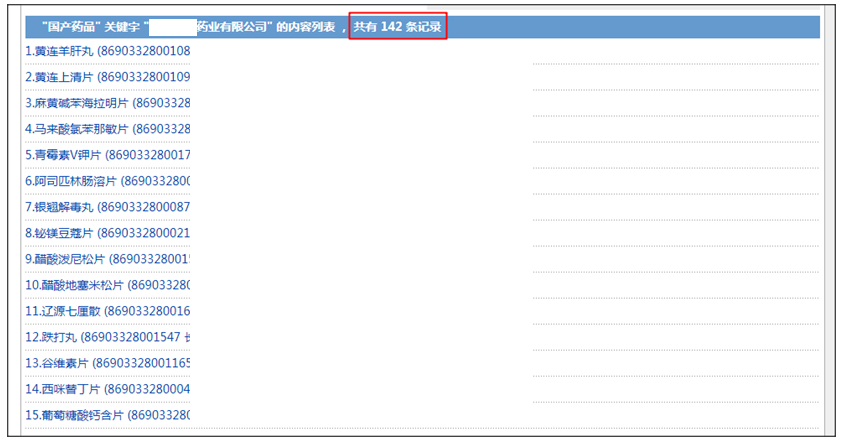
此次涉案企业为吉林省某药业有限公司,该企业共有142个批准文号,品种涉及化学药品与中药,此次涉案品种为中药化痰平喘片。
操作过程
2020年03月06日,涉事企业发现20200304批次化痰平喘片压片过程中片重差异存在异常,有不符合标准的情况,随后涉事企业将片重不符合药片挑出,共约50kg。
2020年03月08日,将不符合要求的药片重新粉碎。
2020年03月12日,重新压片。
2020年03月13日,与该批合格的药片进行铝塑包装,在包装过程中有177板药品因缺片、不规整,涉事企业进行了销毁。
以上粉碎、重新压片、药板销毁均无相应记录。
记录填写过程
涉事企业工艺员先用铅笔填写好压片、内包等岗位记录后,再让相应岗位操作人员用中性笔临摹,签字。
企业可取之处
生产过程能够及时发现片重出现异常,这也可以说该企业的质量监控措施确实得当;能够将不合格的药片进行一一挑出,也可以说企业的质量意识并未泯灭;将不合格的药片重新粉碎,然后进行压片保证产品能够符合注册标准要求,也说明该企业生产经验丰富;铝塑包装过程产生的177板产品能够被及时发现并被销毁,也说明企业没有完全忘记产品质量。以上这些行为,确实是该企业做的比较中规中矩的地方,没有忘记产品的核心--符合注册标准。
企业罪过之处
1、片重出现异常情况没有按照偏差处理
2、不合格药品进行粉碎、重新压片、包装没有经过评估及验证
3、不合格药品进行粉碎、重新压片、包装没有增加额外检验
4、涉事记录由工艺员进行填写,操作员进行临摹
5、粉碎、重新压片、包装、销毁残次品没有相应记录
药品检验合格仍不能被认可
2015版《中国药典》凡例总则第六条规定:正文所设各项规定是针对符合《药品生产质量管理规范 》 (Good Manufacturing Practices, G M P )的产品而言。任何违反 G M P 或有未经批准添加物质所生产的药品,即使符合《中国药典》或按照《中国药典》没有检出其添加物质或相关杂质,亦不能认为其符合规定。
所以产品被为质量符合要求的条件有两个:一是先符合GMP的相关规定;而是符合注册标准要求。二者缺一不可,而企业往往忽略了符合GMP的相关规定这个先决条件。
此次被罚谁之过
出了这个事情,谁之过?
工艺员之过、操作人员之过、车间主任之过、生产负责人之过、质量负责人之过、还是质量受权人之过?
我想这么大个事情,无论之前还是现在的监管环境,任何一个工艺员、操作员、亦或者是车间主任都不敢私自拍板决定。生产考虑的是收率和成本,而此时恰恰就需要质量人员站出来说那一声"不"!
我不知道质量的关键人员说了那句"不"没?亦或者说了,却被成本和收率直接给怼回来了,毕竟一盒药才1.92元,如果不再不考虑收率,大家在被罚之前就得喝西北风。
或许是事情做的多了,意识麻木了,感觉产品质量合格就没啥问题了,质量的人退却了一步,而恰恰就是这一步被罚了二百多万,估计这次生产、质量的人都傻了,心里面估计有无数个如果:
如果挑出来的50kg不合格药片直接销毁,也不用做风险评估了,直接走个偏差,将不合格产品销毁,最为直接简单,再把原因找出,进行整改。
如果能够按照GMP第一百三十四条、第一百三十五条进行实施,哪怕做不全,做不到位也不至于这样子吧!
可这世上没有那么多如果,只有结果,不过他们也应该庆幸没有造成多大的危害,否则这个要是按照刑法处罚,可不就是简简单单罚款这么简单,相关人员要入刑的。
警醒
都说举头三尺有神明,踏踏实实做,做不好是本事不行,不好好做那是良心问题,刑法和管理法恰恰处罚的就是良心问题。
企业的老板们,要想企业发展的好,先改变自己,俗话说上梁不正下梁歪,那些敢和你说想法和不的人,千万别去吼他们,他们也是为你好。



合作咨询
![]() 肖女士
肖女士
![]() 021-33392297
021-33392297
![]() Kelly.Xiao@imsinoexpo.com
Kelly.Xiao@imsinoexpo.com
 2006-2025 上海博华国际展览有限公司版权所有(保留一切权利)
沪ICP备05034851号-57
2006-2025 上海博华国际展览有限公司版权所有(保留一切权利)
沪ICP备05034851号-57