近日,罗氏阿替利珠单抗的第二个上市申请(相关受理号为JXSS2000002)在NMPA的状态变更为"在审批",这意味着其联合贝伐珠单抗用于既往未接受过全身系统性治疗的不可切除肝细胞癌(HCC)的适应症即将获批。
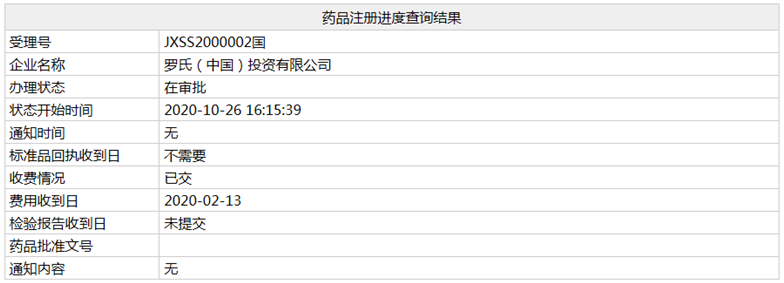
肝细胞癌(HCC)占肝癌的90%以上,由于预后差和治疗选择有限,是全世界癌症死亡的主要原因。据统计,全世界每年有超过75万人被诊断为HCC,其中大部分病例在亚洲,而中国几乎占了一半。而不可切除的肝癌的预后更差,全身药物治疗的选择有限,一年生存率不到50%,迫切需要新疗法。
阿替利珠单抗(atezolizumab)是一种PD-L1免疫检查点抑制剂,通过抑制PD-L1使T细胞重新激活,进而攻击肿瘤细胞。2016年5月,该药被FDA批准用于局部晚期或转移性尿路上皮癌患者的二线治疗,商品名为Tecentriq,成为FDA批准的首个PD-L1抑制剂,随后该药又被批准单药或联合其他药物用于多种类型的癌症治疗,包括肝癌、非小细胞肺癌和广泛期小细胞肺癌、晚期尿路上皮癌、晚期黑色素瘤、PD-L1阳性转移性三阴性乳腺癌(TNBC)、无法切除或转移性肝细胞癌。
其中,Tecentriq+贝伐珠单抗(Avastin)组合疗法一线治疗不可切除或转移性HCC的适应症于2019年5月被FDA批准,成为第一个也是唯一一个被批准用于治疗不可切除性或转移性HCC的癌症免疫治疗方案,而且该方案于今年9月在日本获批,在欧盟也得到了CHMP推荐批准的积极意见,预计很快也将获批。
此外,值得一提的是,该组合疗法早在2018年12月就被FDA批准联合化疗(卡铂和紫杉醇)一线治疗无EGFR或ALK基因组肿瘤畸变的转移性非鳞状非小细胞肺癌(NSq NSCLC)成人患者。
Tecentriq+Avastin组合一线治疗HCC是基于IMbrave150的积极结果。IMbrave150(NCT03434379)是一项开放标签、多中心、随机III期研究,其共同主要终点是由独立评估机构根据实体瘤疗效评价标准1.1版(RECIST 1.1)确定的总生存期(OS)和无进展生存期(PFS),旨在研究Tecentriq与Avastin联合方案相对于标准护理药物--多激酶抑制剂索拉非尼(sorafenib)的疗效和安全性。
该研究共纳入501例既往未接受过系统性治疗的不可切除的HCC患者,研究中患者按照2:1比例随机分配接受Tecentriq+Avastin联合治疗(n=336)或索拉非尼治疗(n=165),直至出现不可接受的**反应或失去临床受益。
结果显示:与索拉非尼组相比,Tecentriq+Avastin联合治疗组总生存期显著延长(中位OS:NE vs 13.2个月)、死亡风险降低42%(HR=0.58,95%CI:0.42-0.79,p=0.0006)、12个月生存率提高(67.2% vs 54.6%)。此外,与索拉非尼组相比,Tecentriq+Avastin联合治疗组疾病无进展生存期显著延长(中位PFS:6.8个月 vs 4.3个月)、疾病进展或死亡风险降低41%(HR=0.59,95%CI:0.47-0.76,p<0.0001)。
值得一提的是,Tecentriq+Avastin组合对于我国肝细胞癌患者同样有效。IMbrave150研究中共纳入194例中国患者,其中133例患者随机接受Tecentriq+贝伐珠单抗治疗,61例接受索拉非尼治疗。研究结果显示:Tecentriq+Avastin作为一线疗法相比索拉非尼显著延长了中国患者的总生存期(未成熟 vs 11.4个月),使死亡风险降低56%(HR = 0.44);同时显著延长了患者PFS(5.7 vs 3.2个月),疾病恶化风险降低40%(HR = 0.60)。该数据与IMbrave 150研究的全球数据一致。安全性方面,Tecentriq+贝伐珠单抗总体上耐受性良好,**可控,与已知数据一致。
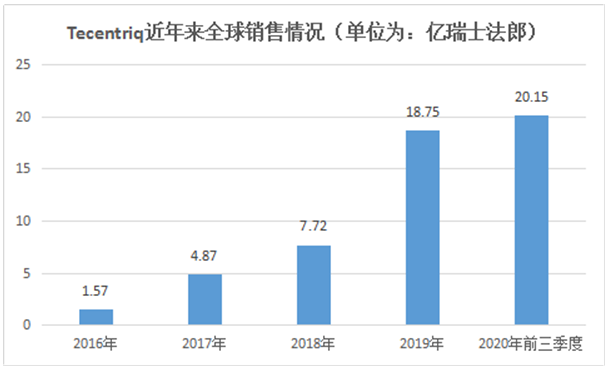
截止目前,Tecentriq已在美国、欧洲等全球多家国家和地区获批,其销售额自上市也是一路飙升,成为罗氏业绩的一款重磅产品,据罗氏2020年前三季度财报Tecentriq今年前三季度的销售额高达20.15亿瑞士法郎。
在国内,Tecentriq于今年2月首次被批准用于治疗小细胞肺癌(SCLC),商品名为泰圣奇。此外,截止目前,该药在国内还递交了3个上市申请(相见下表),其中受理号为JXSS2000033的适应症是用于检测评估为≥50%肿瘤细胞PD-L1染色阳性(TC≥50%)或肿瘤浸润PD-L1阳性免疫细胞(IC)覆盖≥10%的肿瘤面积(IC≥10%)的表皮生长因子受体(EGFR)基因突变阴性和间变性淋巴瘤激酶(ALK)阴性的转移性非小细胞肺癌(NSCLC)患者的一线治疗。
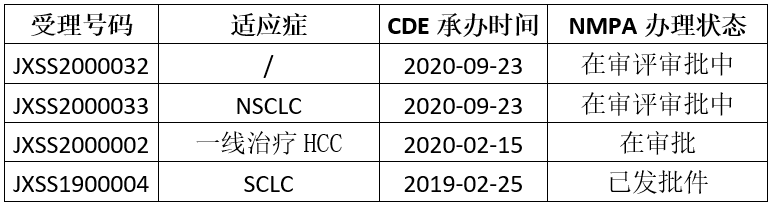
鉴于我国HCC患者人数庞大,Tecentriq+Avastin组合疗法若能在国内被批准作为HCC的一线治疗,无疑将会进一步拉动Tecentriq的销售额增长。
提到肝细胞癌的一线免疫治疗,笔者就会想到PD-1抑制剂Keytruda(pembrolizumab,帕博利珠单抗)+Lenvima(lenvatinib,乐伐替尼)这一组合疗法,不过遗憾的是,今年7月份该组合的上市申请遭了FDA拒批。



合作咨询
![]() 肖女士
肖女士
![]() 021-33392297
021-33392297
![]() Kelly.Xiao@imsinoexpo.com
Kelly.Xiao@imsinoexpo.com
 2006-2025 上海博华国际展览有限公司版权所有(保留一切权利)
沪ICP备05034851号-57
2006-2025 上海博华国际展览有限公司版权所有(保留一切权利)
沪ICP备05034851号-57