本期(11月13日至11月20日)国际、国内多个产品审批审批取得新进展。在国际上,mRNA**接连传来好消息,辉瑞/BioNTech新冠**保护效力达95%,即将向FDA递交新冠**EUA申请。Alnylam第3款创新RNAi疗法欧盟首次获批上市;赛诺菲新一代流感**(重组四价流感**)在欧盟获批上市;FDA拒绝批准赛诺菲补体C1s抑制剂上市;礼来巴瑞替尼获FDA紧急使用授权,治疗COVID-19住院患者;首款可在家中完成的新冠核酸检测获美国FDA EUA授权。
在国内,多个抗肿瘤、抗感染新药报产取得新进展,更多动态如下:
国内审评审批·新动态
本周CDE有25个受理号(16个品种)报生产办理状态更新,其中百济神州来那度胺胶囊、地舒单抗注射液和贝达药业盐酸恩莎替尼胶囊等抗肿瘤新药备受关注,更多动态如下:
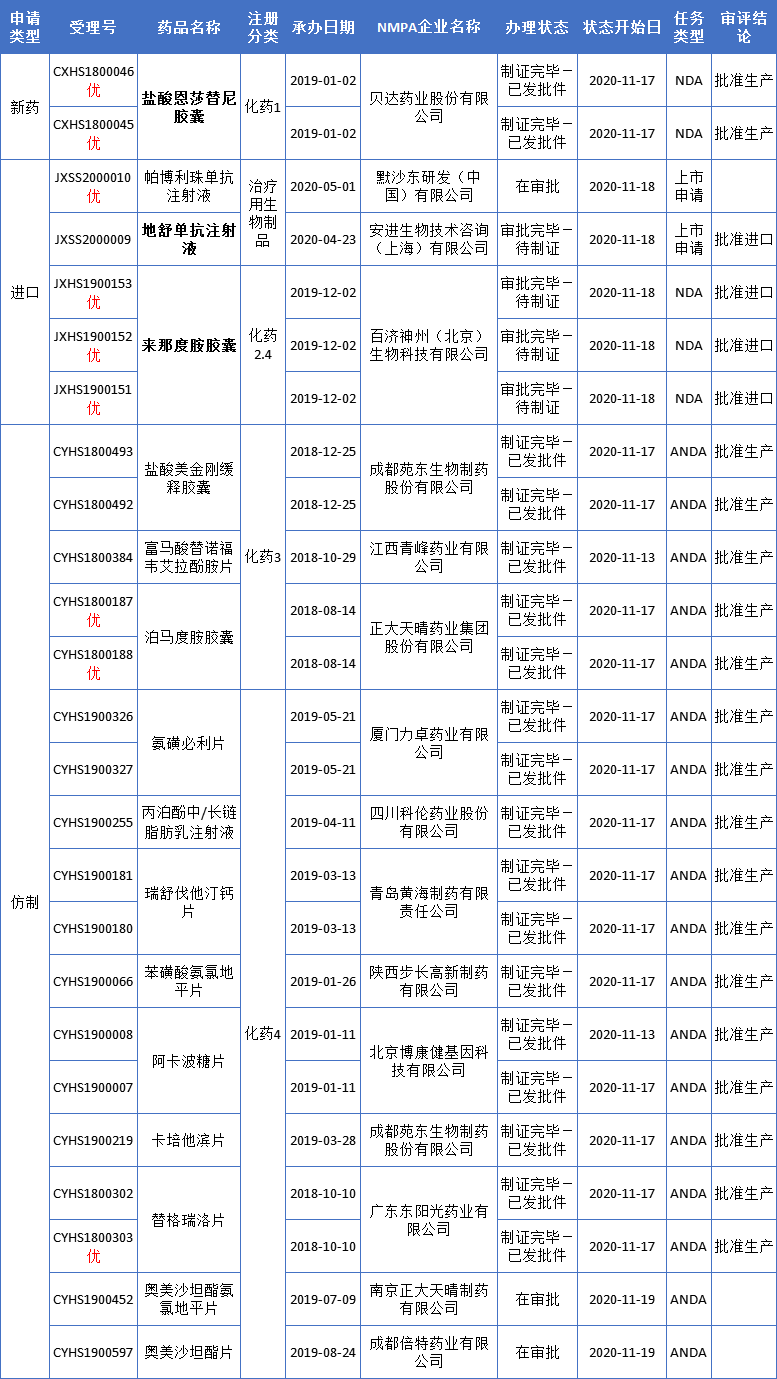
首个国产ALK抑制剂,贝达药业盐酸恩沙替尼上市
11月17日,贝达药业自主研发的ALK抑制剂盐酸恩沙替尼胶囊(商品名:贝美纳)正式在中国获批上市,二线治疗ALK阳性的非小细胞肺癌患者。截至目前,包括贝达药业的恩莎替尼在内,全球共有6款ALK抑制剂获批上市,其中4款已经在国内获批上市。
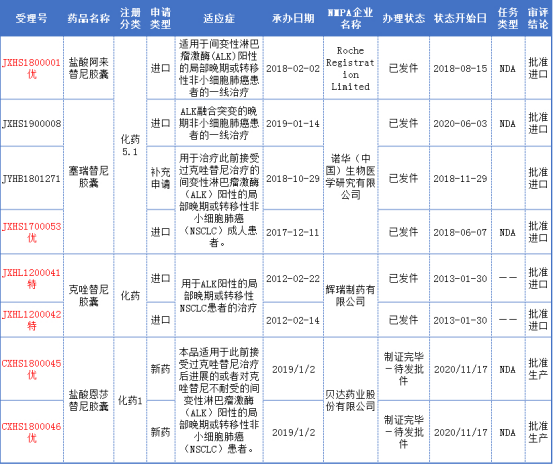
ALK抑制剂中国上市详情表
其中克唑替尼、塞瑞替尼均于2018年10月国家谈判进入乙类全国医保,降价后年费用分别为16-19万、21.7万。阿来替尼于2018年8月获批后,次年即通过谈判进入乙类医保。药智数据企业版医院销售数据库显示,2019年克唑替尼国内样本医院销售额为1.96亿元,同比增长130.87%;塞瑞替尼2019年样本医院销售额为4214.00万元,同比增长544.26%。
恩莎替尼的获批意味着继埃克替尼(凯美纳)之后,贝达药业迎来了第二款上市的创新药。在NSCLC领域,凯美纳和贝美纳这对“姊妹花”未来将会并肩作战,改善更多患者的生活。此外,贝达药业也在积极准备恩沙替尼一线ALK阳性适应症的中美上市申报,一线适应症计划于明年申报NDA。若一线治疗能顺利获批,将大大有助于恩沙替尼的快速放量及未来销售空间。
百济神州进入密集收获期,来那度胺片、地舒单抗新进展!
来那度胺获批第三个适应症,治疗复发/难治性惰性淋巴瘤。此前,该药拟用于与利妥昔单抗合用,治疗复发或难治性惰性淋巴瘤(滤泡性或边缘区淋巴瘤)患者的上市申请曾获药品审评中心(CDE)纳入优先审评,理由是具有明显治疗优势。来那度胺是百时美施贵宝公司(BMS)旗下新基公司开发的一种口服免疫调节药物。2017年7月,百济神州通过与新基公司达成战略合作获得了该药在中国的独家经销权。自2013年首次在中国获批上市以来,来那度胺在中国获批两项针对成年多发性骨髓瘤患者的适应症。
地舒单抗获批预防实体瘤骨转移及多发性骨髓瘤引起的骨相关事件。安加维?(地舒单抗注射液)由安进公司(Amgen)开发,百济神州根据今年早先达成的全球肿瘤战略合作获得其授权。此外,安加维?在中国已获批用于治疗不可手术切除或者手术切除可能导致严重功能障碍的骨巨细胞瘤(GCTB)患者,并完成商业化上市。地舒单抗是一种新型RANKL抑制剂 ,是RANKL的全人化单克隆IgG2抗体,对可溶性、跨膜形式的人RANKL具有高度亲和力和特异性。地舒单抗通过与RANKL信号通路结合,防止破骨细胞形成、发挥功能和生存。
国内审评审批·新受理
本周CDE新增报生产受理号20个,共16个品种,其中南京圣和药业和乐布韦片、默沙东莱特莫韦和勃林格殷格翰恩格列净片备受关注,更多动态见下表:
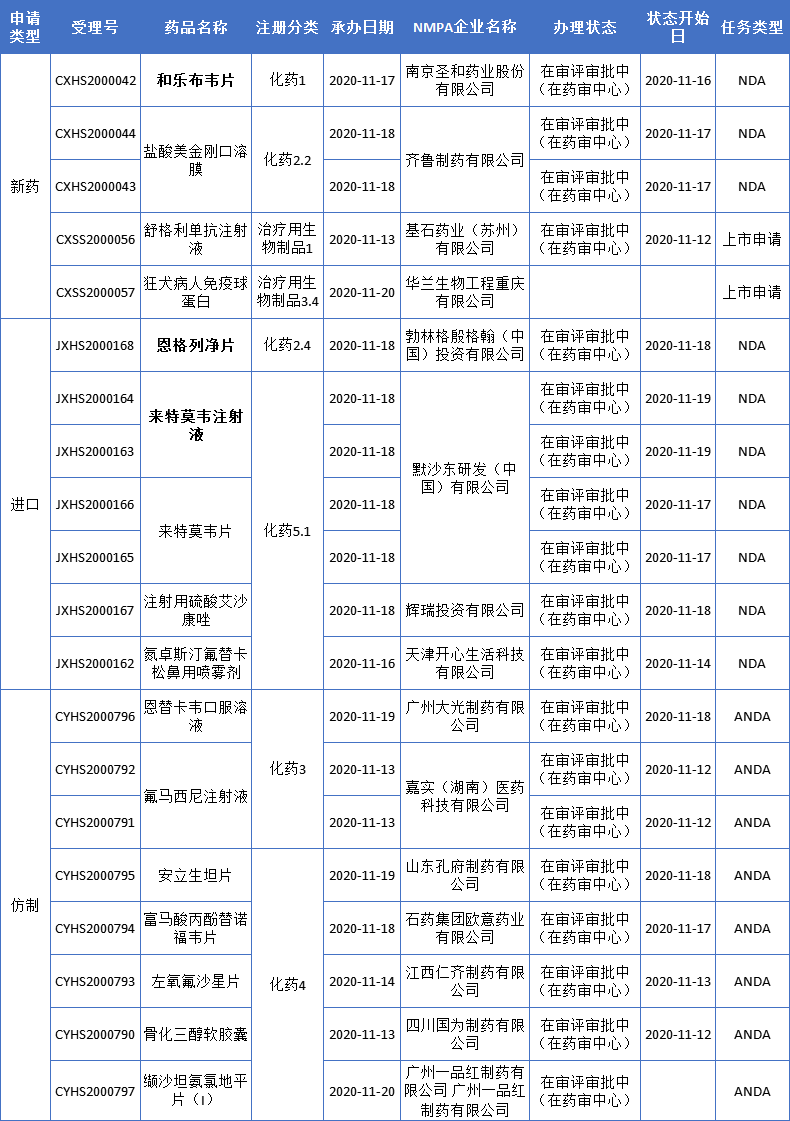
恩格列净新适应症上市申请获CDE受理
11月18日,CDE受理了勃林格殷格翰SGLT2抑制剂恩格列净片的一项进口新药上市申请,新申报的适应症为治疗射血分数降低的心力衰竭成人患者。
2014年,恩格列净获得美国FDA批准,用于2型糖尿病患者。之后它用于降低伴有心血管疾病的成人2型糖尿病患者的心血管死亡风险的新适应症再次获得FDA批准,成为全球首个经大型心血管结局研究证实,能降低心血管死亡风险的2型糖尿病药物。在中国,恩格列净于2017年9月首次获批,用于配合饮食控制和运动,可单药、联合****或联合****和磺脲类药物治疗,改善2型糖尿病患者的血糖控制。此次则是这款药物在中国申请上市的第二个适应症,恩格列净有望在不久的未来,给更多心衰患者带来新的治疗选择。此外,勃林格和礼来还在进一步探索恩格列净用于射血分数保留的成人心衰患者的治疗,预计明年将公布结果。
国内目前已上市多个SGLT2抑制剂,包括达格列净、卡格列净、恩格列净、艾格列净,以进口为主,但卡格列净和恩格列净已有仿制药上市。对于SGLT2抑制剂的开发,也有多个品种进入临床,其中进入III期临床试验的有江苏恒瑞的恒格列净、山东轩竹医药的加格列净、广东东阳光的荣格列净。
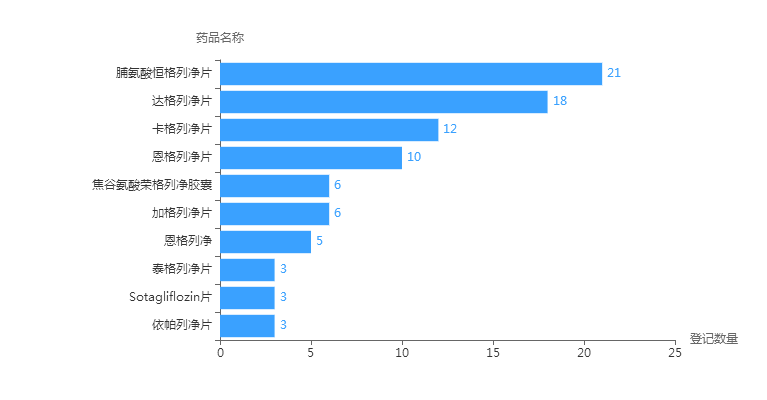
数据来源:药智中国临床试验数据库
默沙东抗CMV感染新药在中国申报上市
11月18日,默沙东(MSD)抗病毒 药物来特莫韦(letermovir)提交四项新药上市申请获CDE受理,包括注射液和片剂两种剂型。今年6月,来特莫韦曾在获得CDE四项临床试验默示许可,拟开发适应症为:用于异基因造血干细胞移植的巨细胞病毒血清反应阳性的成人受者[R+]预防CMV再激活和疾病。
来特莫韦是一种新型非核苷CMV抑制剂(3,4-二氢喹唑啉),在美国、欧盟和日本,来特莫韦曾被授予孤儿药资格预防巨细胞病毒疾病。2017年11月,FDA批准来特莫韦口服片剂和静脉注射液,对于接受异基因造血干细胞移植后CMV血清呈阳性的成人患者,可用于预防CMV感染和相关疾病。据悉来特莫韦是15年来在美国批准的首款治疗CMV感染新药。
南京圣和丙肝新药和乐布韦申报上市
11月17日,南京圣和1类新药和乐布韦片(SH229)上市申请获得国家药监局受理,用于治疗慢性丙肝。和乐布韦是圣和药业自主设计研发的国内首个NS5B抑制剂,肝靶向能力强,抗病毒活性高,非临床研究数据证实,SH229对基因1-6型HCV的体外抗病毒活性为索磷布韦的2-3倍。一项Ⅱ期临床CTR20182539结果显示,SH229联合达拉他韦在1/2型HCV感染患者中的SVR12(12周病毒持续响应率)达到100%,在6型HCV感染患者中的SVR12达到93.3%。该药是圣和药业首个申报上市的品种。



合作咨询
![]() 肖女士
肖女士
![]() 021-33392297
021-33392297
![]() Kelly.Xiao@imsinoexpo.com
Kelly.Xiao@imsinoexpo.com
 2006-2025 上海博华国际展览有限公司版权所有(保留一切权利)
沪ICP备05034851号-57
2006-2025 上海博华国际展览有限公司版权所有(保留一切权利)
沪ICP备05034851号-57