本期(11月20日至11月27日)国际、国内审评加速,多个产品审批审批取得新进展,上市新药仍以生物药为主。
在国际上,多个重磅新药获批上市!强生TREMFYA治疗活动性银屑病关节炎获欧盟批准上市;百时美施贵宝Opdivo获欧盟批准,为欧洲首个食管癌免疫疗法!赛诺菲巴斯德(Sanofi-Pasteur)**MenQuadfi?获欧盟批准,用于12个月及以上人群预防脑膜炎球菌病。罗氏Xofluza成首个获FDA批准用于暴露后预防的单剂量流感药物;首个儿童早老症疗法Zokinvy获美国FDA批准上市;Alnylam全球第三款RNAi药物Oxlumo获美国FDA批准;Y-mAbs Therapeutics靶向GD2(去唾液酸神经节苷脂)单抗Danyelza?(naxitamab) 获得FDA批准上市,用于治疗复发/难治性高危神经母细胞瘤的儿童患者。再生元新冠中和抗体组合疗法、礼来巴瑞替尼获FDA紧急使用授权用于新冠。
在国内,本期多款单抗获批进口,多个新药、仿制药审评审批取得新进展,更多动态如下:
国内审评审批·新动态
本周CDE有85个受理号(54个品种)报生产办理状态更新,其中豪森药业奥氮平口腔速溶膜、复宏汉霖阿达木单抗和默沙东多拉韦林片备受关注,更多动态如下:

豪森2.2类新药奥氮平口腔速溶膜获批上市
近日,豪森药业2.2类新药奥氮平口腔速溶膜获批上市。奥氮平原研药由礼来公司开发,主要用于治疗**分裂症,奥氮平也适用于治疗中度到重度的躁狂发作,对治疗有效的躁狂发作患者,奥氮平可以预防双相情感障碍的复发。
在中国,奥氮平原研药于1998年首次获批,目前已有多家公司开发的奥氮平仿制药获批上市。药智数据显示,此前中国获批上市的奥氮平有两种剂型——片剂和口崩片,尚无口腔速溶膜剂产品获批上市,本次获批意味着它成为了首个在中国获批的奥氮平口腔速溶膜剂型。此外,齐鲁制药的奥氮平口溶膜正在审评审批中。
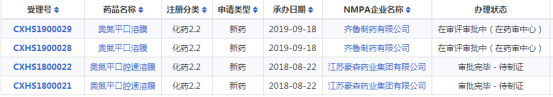
早前,豪森药业的奥氮平片和奥氮平口崩片均已通过仿制药一致性评价,获批上市,其中豪森药业的奥氮平片是该品种的首仿。
国产第 4 家!复宏汉霖阿达木单抗即将获批
药智数据显示,复宏汉霖阿达木单抗注射液上市申请已进入行政审批阶段,预计近期即将获批成为第四个国产阿达木单抗生物类似药。
阿达木单抗(修美乐)是艾伯维 (Abbvie) 研发的第一个完全人源化抗肿瘤坏死因子-α(TNF-α)的单克隆抗体,自上市以来,全球已批准其用于治疗包括类风湿关节炎、强直性脊柱炎、银屑病、银屑病关节炎、幼年特发性关节炎、克罗恩病(包括儿童克罗恩病)、溃疡性结肠炎、化脓性汗腺炎、葡萄膜炎等十七种疾病。 2010 年 2 月 ,修美乐首次国内获批进口,2019 年 11 月 ,首个国产阿达木单抗生物类似药获批上市,来自百奥泰(商品名:格乐立)。
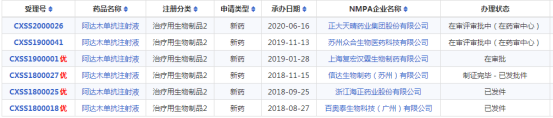
目前,国内除百奥泰、海正、复宏汉霖和信达外,君实生物、正大天晴的生物类似药也在上市审评审批中,阿达木单抗生物类似药在国内的竞争已经白热化。在 2019 医保谈判过程中,修美乐降价 59% 成功进医保;目前三个已上市的阿达木单抗生物类似药定价一致,均为1150 元/支/0.8ml:40mg。
默沙东抗艾新药多拉韦林在中国获批上市!
近日,默沙东(MSD)多拉韦林片新药上市申请获得批准,适应症为:适用于与其他抗反转录病毒 药物联合治疗HIV-1感染且无NNRTI(非核苷逆转录酶抑制剂)类耐药的既往或现有证据的成年患者。
多拉韦林(doravirine)是由默沙东公司开发的一种每日一次的口服创新非核苷逆转录酶抑制剂。2018年8月,多拉韦林单药及其复方制剂获得美国FDA批准上市,用于治疗未接受过抗病毒疗法的成年HIV-1感染患者。该药物可以作为单片制剂与其它抗病毒疗法灵活组合,或者与拉米夫定和替诺福韦组合形成固定剂量复方制剂。此次在中国获得批准上市的是多拉韦林单药片剂,该上市申请曾被CDE纳入优先审评。
国内审评审批·新受理
本周CDE新增报生产受理号27个,共20个品种,其中默沙东帕博利珠单抗和豪森药业艾替班特、地拉罗司备受关注,更多动态见下表:
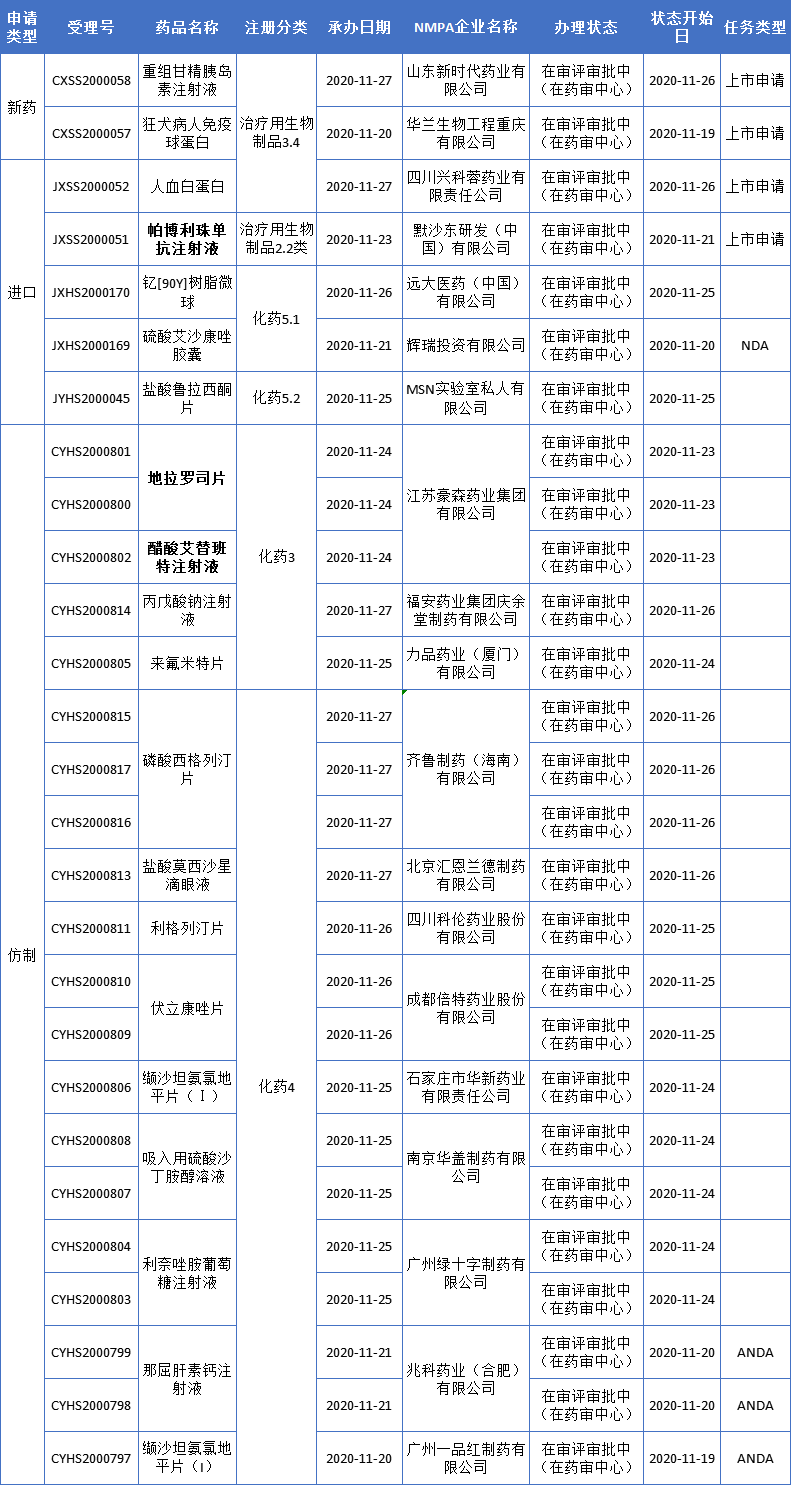
豪森2款3类仿制药品种报产
11月24日,江苏豪森艾替班特、地拉罗司2款仿制药品种的上市申请获得CDE承办受理。
艾替班特是夏尔开发的一种选择性缓激肽B2受体拮抗剂,用于治疗HAE急性发作。该药于2008年7月在欧盟获批,2011年8月获得FDA批准上市,国内进口申请于6月11日纳入优先审评。豪森药业是国内首个该品种报产厂家。值得关注的是豪森药业的艾替班特注射液已于2020年3月获得FDA批准上市。
地拉罗司是诺华开发的一种口服铁螯合剂,于2005年获得FDA批准上市,主要用于治疗2岁及以上因输血导致的慢性铁过载患者,以及10岁以上非输血依赖性地中海贫血(NTDT)患者的慢性铁过载治疗。地拉罗司是首个获FDA批准的可常规使用的口服铁螯合剂,目前已经在全球超过80个国家获批,据诺华年报显示,其2019年全球销售额为9.75亿美元。目前该品种国内上市的是分散片,豪森是片剂首个报产厂家。
默沙东Keytruda新适应症上市申请获CDE受理
据药智数据显示,近日默沙东(MSD)PD-1抑制剂帕博利珠单抗注射液(Keytruda,pembrolizumab)递交的新适应症上市申请已获CDE受理。截至目前,默沙东共计在中国递交了7项帕博利珠单抗注射液的上市申请。其中5项上市申请均已在中国获批。另外,帕博利珠单抗用于特定复发性头颈部鳞状细胞癌一线单药治疗的新药上市申请目前正在审评审批中。
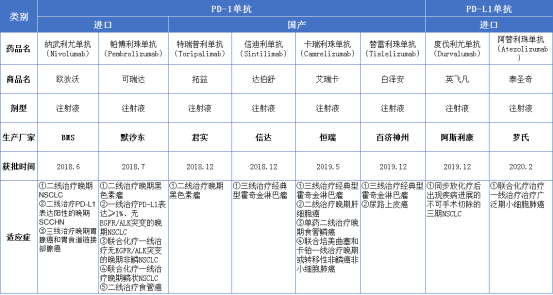
两周前,帕博利珠单抗一线治疗结直肠癌的适应症以“符合附条件批准的药品”被CDE拟纳入优先审评,但并未公布受理号。据此推测,此次该产品在中国递交的新适应症上市申请,对应的适应症为结直肠癌一线治疗。在美国,帕博利珠单抗用于结直肠癌的扩展适应症,已于今年6月底获得FDA批准。
此外,帕博利珠单抗共计在中国登记开展了40多项临床试验,且大多数为3期国际多中心临床研究。除了已获批的适应症外,进展至3期的临床研究,针对适应症领域有肝细胞癌(HCC)、胃癌、乳腺癌、胃食管交界处腺癌、宫颈癌、前列腺癌、尿路上皮癌、胆管癌、子宫内膜癌等。



合作咨询
![]() 肖女士
肖女士
![]() 021-33392297
021-33392297
![]() Kelly.Xiao@imsinoexpo.com
Kelly.Xiao@imsinoexpo.com
 2006-2025 上海博华国际展览有限公司版权所有(保留一切权利)
沪ICP备05034851号-57
2006-2025 上海博华国际展览有限公司版权所有(保留一切权利)
沪ICP备05034851号-57